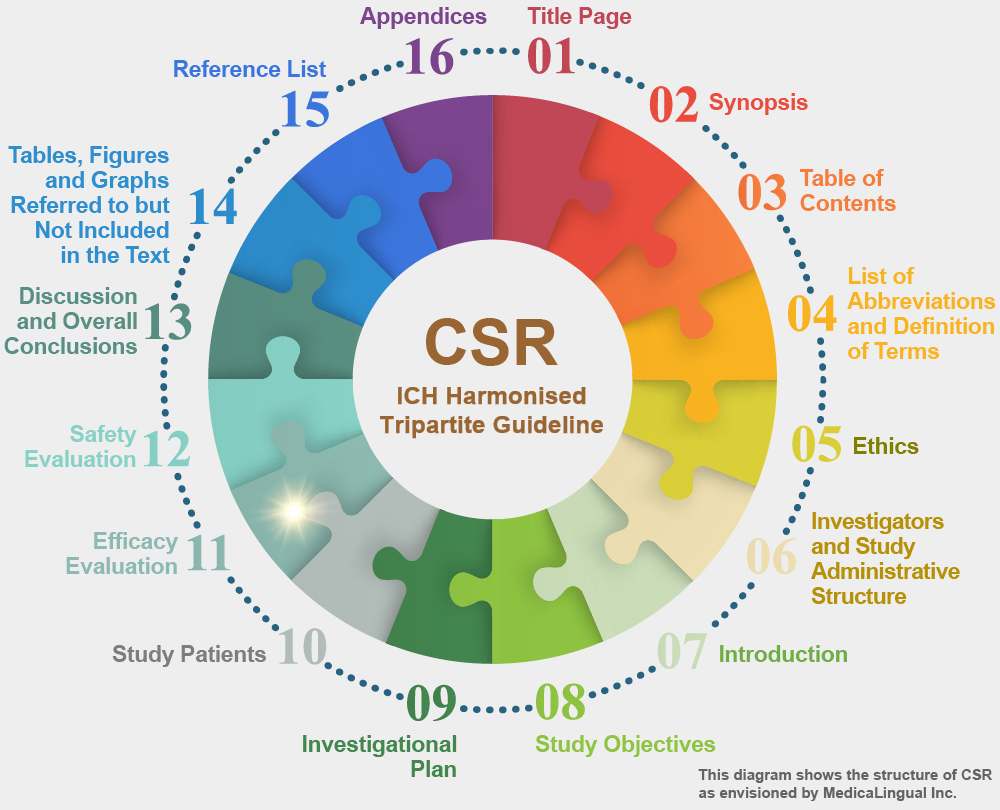
治験の統括報告書の構成と内容に関するガイドライン
平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
11. 有効性の評価
11.4 有効性に関する成績及び個別患者データ一覧表
11.4.5 薬物―薬物及び薬物―疾患の相互作用
反応と併用療法,並びに反応と既往歴及び(又は)合併症との間に関連が認められた場合には,全て記述すること。
11. EFFICACY EVALUATION
11.4 EFFICACY RESULTS AND TABULATIONS OF INDIVIDUAL PATIENT DATA
11.4.5 DRUG-DRUG AND DRUG-DISEASE INTERACTIONS
Any apparent relationship between response and concomitant therapy and between response and past and/or concurrent illness should be described.










