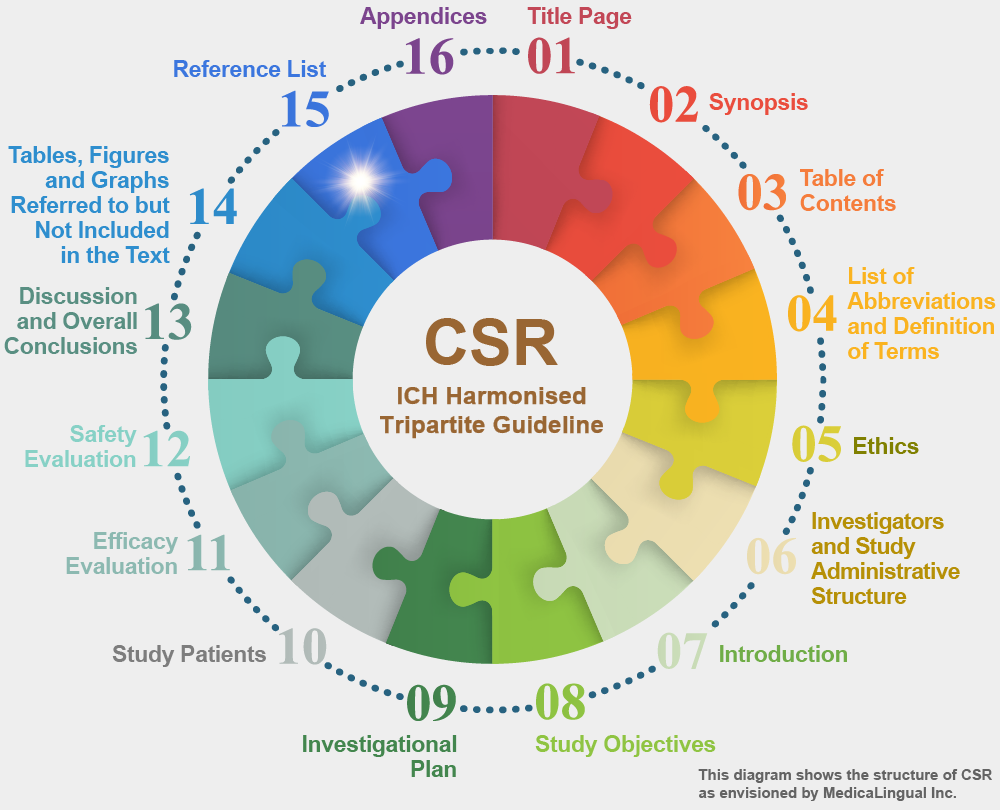
治験の統括報告書の構成と内容に関するガイドライン
平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
15. 引用文献の一覧表
治験の評価に関連する文献一覧表を提出すること。
付録(16.1.11及び16.1.12)に重要な公表文献の写しを添付すること。引用文献は,「生物医学雑誌に投稿する原稿についての統一した要求事項」についての1979年のバンクーバー規約で国際的に認められている基準,又は「Chemical Abstracts」に使われている方式に従って示すこと。
15. REFERENCE LIST
A list of articles from the literature pertinent to the evaluation of the study should be provided.
Copies of important publications should be attached in an appendix (16.1.11 and 16.1.12). References should be given in accordance with the internationally accepted standards of the 1979 Vancouver Declaration on “Uniform Requirements for Manuscripts Submitted to Biomedical Journals” or the system used in “Chemical Abstracts”.










