薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
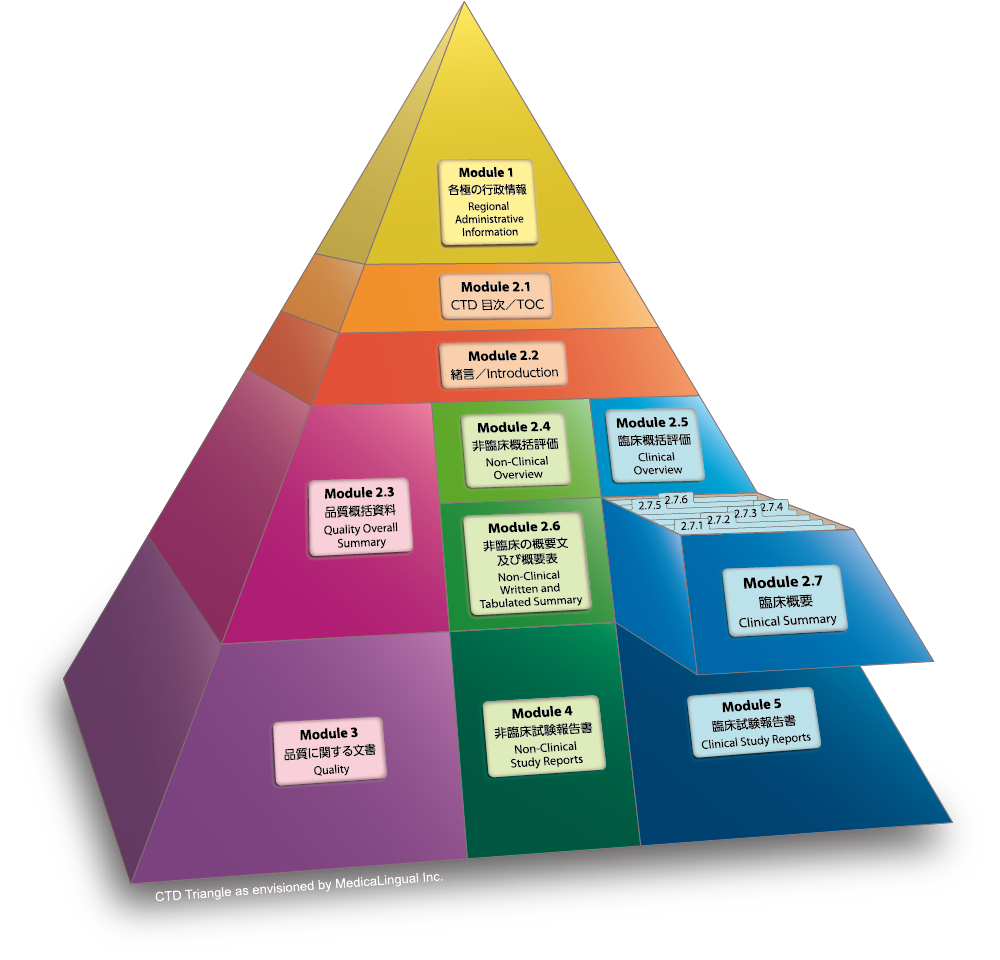
Module 2.7 臨床概要
2.7.1 生物薬剤学及び関連する分析法の概要
2.7.1.1 背景及び概観
本項では製剤開発過程、in vitro 及び in vivo での製剤特性、バイオアベイラビリティ(BA)、比較 BA、生物学的同等性(BE)、in vitro 溶出特性に関する情報の収集に用いた方法と根拠の概観を示すこと。試験の計画及び実施に際して参照したガイドライン又は文献を示すこと。また、本項では用いた分析法の概観について、特に分析法バリデーションの成績特性(例:線形範囲、感度、特異性)及び品質管理(例:正確性及び精度)に重点をおいて示すこと。本項には個々の試験に関する詳細な情報は記載しないこと。
Module 2.7 CLINICAL SUMMARY
2.7.1 Summary of Biopharmaceutic Studies and Associated Analytical Methods
2.7.1.1 Background and Overview
This section should provide the reviewer with an overall view of the formulation development process, the in vitro and in vivo dosage form performance, and the general approach and rationale used in developing the bioavailability (BA), comparative BA, bioequivalence (BE), and in vitro dissolution profile database. Reference should be made to any guidelines or literature used in planning and conducting the studies. This section should also provide the reviewer with an overview of the analytical methods used, with emphasis on the performance characteristics of assay validation (e.g., linearity range, sensitivity, specificity) and quality control (e.g., accuracy and precision). This section should not include detailed information about individual studies.










