薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
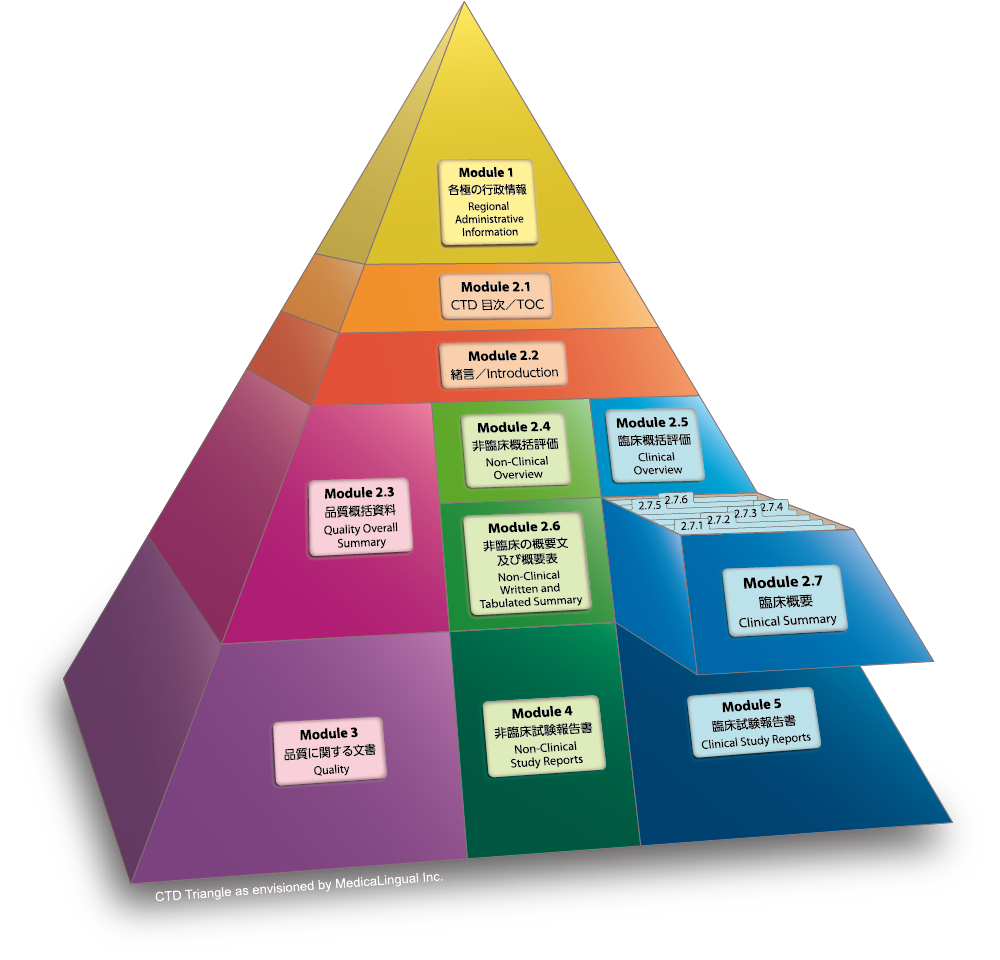
Module 2.7 臨床概要
2.7.2 臨床薬理の概要
2.7.2.2 個々の試験結果の要約
全ての臨床薬理試験を、通常、一覧表で提示し(第2.7.2項の付録を参照)、PK、PD及びPK/PD関係に関するin vitro又はin vivoのデータと情報が得られた重要な個々の試験の内容と結果について、簡単な説明を付け加えること。説明は、論文抄録のように簡潔なものとし、デザイン上の特徴及び重要な結果のみを記載すること。個々の試験結果及び試験間の重要な違いに着目して、試験デザインが似ているものはまとめて表記してもよい。また、本項から各総括報告書へ参照できるように配慮しておくか、電子的リンクを貼りつけておくこと。
Module 2.7 CLINICAL SUMMARY
2.7.2 Summary of Clinical Pharmacology Studies
2.7.2.2 Summary of Results of Individual Studies
A tabular listing of all clinical pharmacology studies should generally be provided (see 2.7.2.5 Appendix), together with a narrative description of the relevant features and outcomes of each of the critical individual studies that provided in vitro or in vivo data and information relevant to PK, PD and PK/PD relationships. The narrative descriptions should be brief, e.g., similar to an abstract for a journal article, and should describe critical design features and critical results. Similar studies may be described together, noting the individual study results and any important differences among the studies. References or electronic links to the full report of each study should be included in the narratives.
薬力学的エンドポイントを用いた用量-反応又は濃度-反応試験の要約を本項に含めること。しかし、これらが適切に管理された試験であり、有効性又は安全性に関する重要なデータが得られる場合には、第2.7.3項又は第2.7.4項で要約し、ここでは引用するのみとする。
Summaries of dose-response or concentration response (PK/PD) studies with pharmacodynamic endpoints should generally be included in this section. In some cases, however, when well-controlled dose-response PD or PK/PD studies provide important evidence of efficacy or safety, they should be placed in 2.7.3 or 2.7.4 as appropriate and referenced, but not summarised, here.










