薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
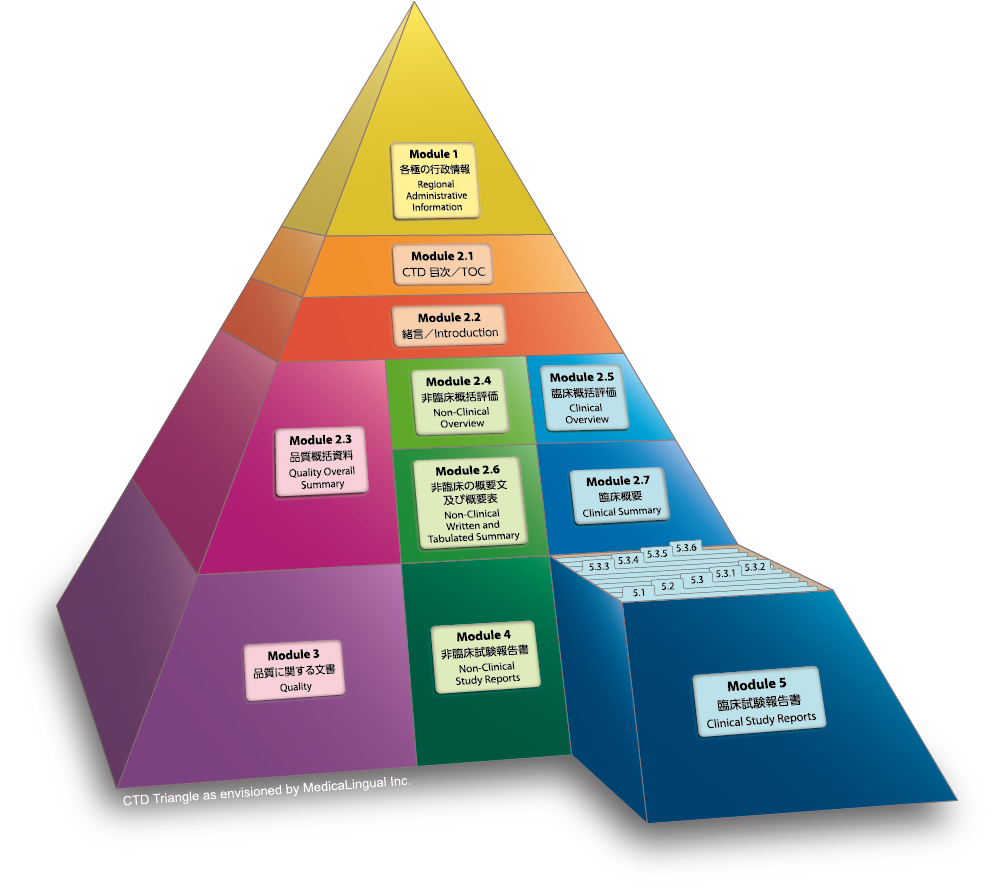
Module 5 臨床試験報告書
5.2 臨床試験一覧表
全ての臨床試験及び関連情報の一覧表を作成すること。試験ごとの記載内容は、通常、本ガイドラインの表5.1に示す情報が含まれることになる。その他の情報は、申請者が有用と判断するものを含めてよい。順序は、下記第5.3項の配列に従うこと。異なる配列を使用する場合は、一覧表の序文にその旨を説明すること。
Module 5 CLINICAL STUDY REPORTS
5.2 Tabular Listing of All Clinical Studies
A tabular listing of all clinical studies and related information should be provided. For each study, this tabular listing should generally include the type of information identified in Table 5.1 of this guideline. Other information can be included in this table if the applicant considers it useful. The sequence in which the studies are listed should follow the sequence described in Section 5.3 below. Use of a different sequence should be noted and explained in an introduction to the tabular listing.










