医薬審発第899号 CTD通知(別紙 4)
CTD—非臨床に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE – M4S –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
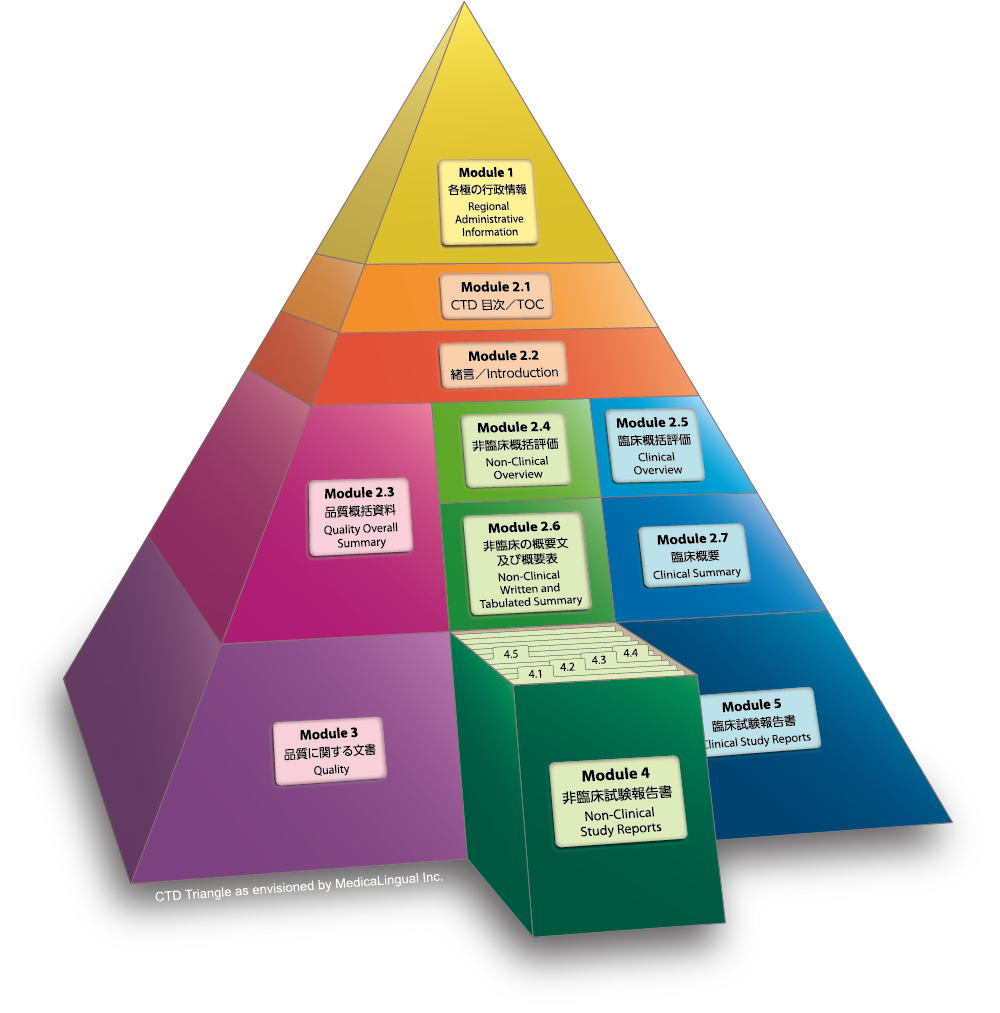
Module 4 非臨床試験報告書
本ガイドラインは、規制当局に提出する承認申請のためのCTD中での非臨床試験報告書の配列に関して合意された様式を示すものである。
本ガイドラインは、どのような試験が要求されるのかを示すものではなく、得られたデータを記載する際の適切な様式を示しているものである。
個別データは,試験報告書中あるいは試験報告書に付表として添付しても差し支えない。
Module 4 NONCLINICAL STUDY REPORTS
This guideline presents an agreed format for the organisation of the nonclinical reports in the Common Technical Document for applications that will be submitted to Regulatory Authorities.
This guideline is not intended to indicate what studies are required. It merely indicates an appropriate format for the nonclinical data that have been acquired.
The appropriate location for individual-animal data is in the study report or as an appendix to the study report.










