医薬審発第899号 CTD通知(別紙 4)
CTD—非臨床に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE – M4S –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
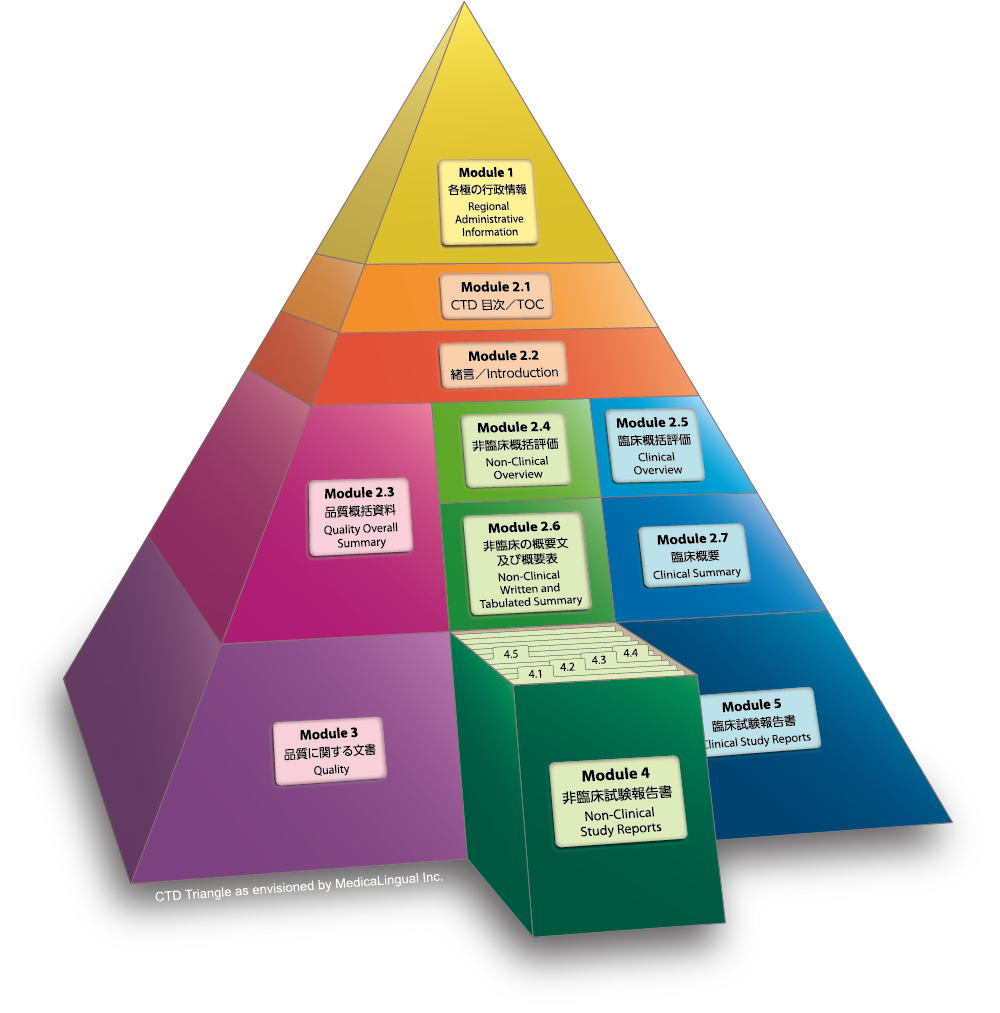
Module 4 非臨床試験報告書
4.1 目次
目次には、全ての非臨床試験の試験報告書の一覧を記載し、各試験報告書のCTD中での所在を示すこと。
Module 4 NONCLINICAL STUDY REPORTS
4.1 Table of Contents
A Table of Contents should be provided that lists all of the nonclinical study reports and gives the location of each study report in the Common Technical Document.










