医薬審発第899号 CTD通知(別紙 4)
CTD—非臨床に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE – M4S –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
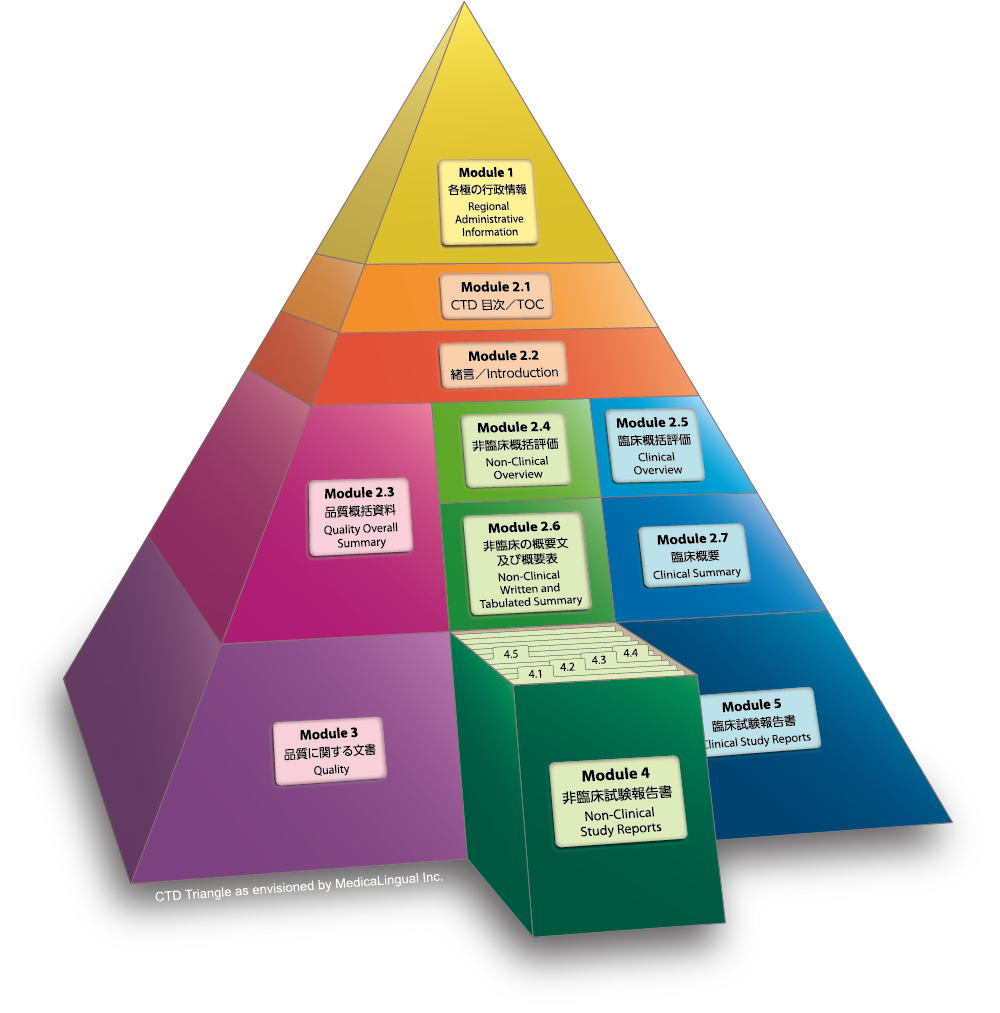
Module 4 非臨床試験報告書
4.2 試験報告書
試験報告書は下記の順に示すこと。
4.2.1 薬理試験
4.2.1.1 効力を裏付ける試験
4.2.1.2 副次的薬理試験
4.2.1.3 安全性薬理試験
4.2.1.4 薬力学的薬物相互作用試験
Module 4 NONCLINICAL STUDY REPORTS
4.2 Study Reports
The study reports should be presented in the following order
4.2.1 Pharmacology
4.2.1.1 Primary Pharmacodynamics
4.2.1.2 Secondary Pharmacodynamics
4.2.1.3 Safety Pharmacology
4.2.1.4 Pharmacodynamic Drug Interactions
4.2.2 薬物動態試験
4.2.2.1 分析法及びバリデーション報告書(別報告書として入手できる場合)
4.2.2.2 吸収
4.2.2.3 分布
4.2.2.4 代謝
4.2.2.5 排泄
4.2.2.6 薬物動態学的薬物相互作用(非臨床)
4.2.2.7 その他の薬物動態試験
4.2.2 Pharmacokinetics
4.2.2.1 Analytical Methods and Validation Reports (if separate reports are available)
4.2.2.2 Absorption
4.2.2.3 Distribution
4.2.2.4 Metabolism
4 2.2.5 Excretion
4.2.2.6 Pharmacokinetic Drug Interactions (nonclinical)
4.2.2.7 Other Pharmacokinetic Studies
4.2.3 毒性試験
4.2.3.1 単回投与毒性試験(動物種、投与経路順に)
4.2.3.2 反復投与毒性試験(動物種、投与経路、投与期間順に;トキシコキネティクスの評価を含む)
4.2.3.3 遺伝毒性試験
- 4.2.3.3.1 In Vitro試験
- 4.2.3.3.2 In Vivo試験(トキシコキネティクスの評価を含む)
4.2.3.4 がん原性試験(トキシコキネティクスの評価を含む)
- 4.2.3.4.1 長期がん原性試験(動物種順に;用量設定試験も含む、ただし、反復投与毒性試験又は薬物動態試験で行われたものは除く)
- 4.2.3.4.2 短期又は中期がん原性試験(用量設定試験も含む、ただし、反復投与毒性試験又は薬物動態試験で行われたものは除く)
- 4.2.3.4.3 その他の試験
4.2.3.5 生殖発生毒性試験(用量設定試験及びトキシコキネティクスの評価を含む)(変更した試験デザインを用いた場合には、それに伴って試験表題も変更すること)
- 4.2.3.5.1 受胎能及び着床までの初期胚発生に関する試験
- 4.2.3.5.2 胚・胎児発生に関する試験
- 4.2.3.5.3 出生前及び出生後の発生並びに母体の機能に関する試験
- 4.2.3.5.4 新生児を用いた試験(実施された場合)
4.2.3.6 局所刺激性試験
4.2.3.7 その他の毒性試験(実施されている場合)
- 4.2.3.7.1 抗原性試験
- 4.2.3.7.2 免疫毒性試験
- 4.2.3.7.3 毒性発現の機序に関する試験(他項に含まれていない場合)
- 4.2.3.7.4 依存性試験
- 4.2.3.7.5 代謝物の毒性試験
- 4.2.3.7.6 不純物の毒性試験
- 4.2.3.7.7 その他の試験
4.2.3 Toxicology
4.2.3.1 Single-Dose Toxicity (in order by species, by route)
4.2.3.2 Repeat-Dose Toxicity (in order by species, by route, by duration; including supportive toxicokinetics evaluations)
4.2.3.3 Genotoxicity
- 4.2.3.3.1 In vitro
- 4.2.3.3.2 In vivo (including supportive toxicokinetics evaluations)
4.2.3.4 Carcinogenicity (including supportive toxicokinetics evaluations)
- 4.2.3.4.1 Long-term studies (in order by species; including range-finding studies that cannot appropriately be included under repeat-dose toxicity or pharmacokinetics)
- 4.2.3.4.2 Short- or medium-term studies (including range-finding studies that cannot appropriately be included under repeat-dose toxicity or pharmacokinetics)
- 4.2.3.4.3 Other studies
4.2.3.5 Reproductive and Developmental Toxicity (including range-finding studies and supportive toxicokinetics evaluations) (If modified study designs are used, the following sub-headings should be modified accordingly.)
- 4.2.3.5.1 Fertility and early embryonic development
- 4.2.3.5.2 Embryo-fetal development
- 4.2.3.5.3 Prenatal and postnatal development, including maternal function
- 4.2.3.5.4 Studies in which the offspring (juvenile animals) are dosed and/or further evaluated.
4.2.3.6 Local Tolerance
4.2.3.7 Other Toxicity Studies (if available)
- 4.2.3.7.1 Antigenicity
- 4.2.3.7.2 Immunotoxicity
- 4.2.3.7.3 Mechanistic studies (if not included elsewhere)
- 4.2.3.7.4 Dependence
- 4.2.3.7.5 Metabolites
- 4.2.3.7.6 Impurities
- 4.2.3.7.7 Other










