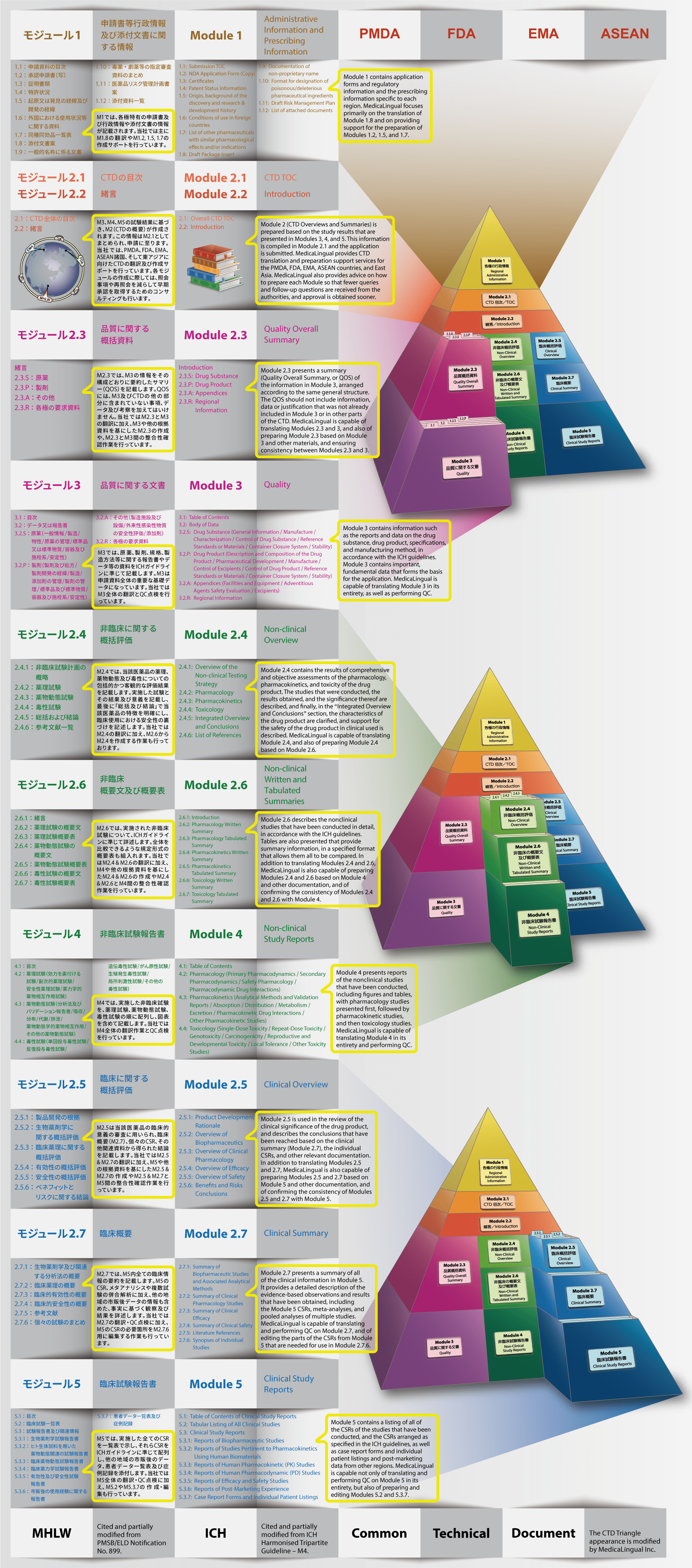
国際共通化資料の翻訳と作成
Translation and Preparation of CTD
当社では、CTDの5つのモジュール全てにわたる翻訳及びメディカルライティングを行っています。特にモジュール2.5と2.7(臨床)及びモジュール2.4と2.6(非臨床)で実績を積んでおります。
CTDの翻訳及びメディカルライティング業務においては、当社からお客様への初回納品後に、以下の一連のプロセスを経て最終化に至ります。
①クライアント側での複数回にわたるレビューと修正
②クライアントからのフィードバックを受けての当社側での修正(クライアント側での必要に応じ複数回実施)
③当社側での英語ネイティブチェック(英語メディカルライティングの場合)
④クライアント側で確認された最終ドラフトに対する、当社側でのQC点検及びQC点検後の最終版の作成(CTD規定テンプレート編集を含む)
⑤最終版納品後、QC点検証跡、品質管理証明書、翻訳証明書を提出

MedicaLingual has a wealth of experience in the translation and medical writing tasks required for the preparation of all 5 CTD modules, particularly of Modules 2.5 and 2.7 (Clinical) and 2.4 and 2.6 (Non-Clinical).
Our CTD translation and medical writing services cover the following series of processes until the finalization after the first delivery to the client from us:
After an extensive review and revision process in which the document is reviewed by the client, the document is revised by MedicaLingual based on the feedback received multiple times, depending on the needs of the client.
It may then also be reviewed by native English speakers at MedicaLingual if it is written in English and subjected to QC inspections by MedicaLingual of the final draft confirmed by the client, followed by the preparation of a QC’d finished version (including formatting for use in specified CTD templates) at MedicaLingual.
MedicaLingual presents the client with QC inspection traceability assurance, a quality control certificate or a translation certificate for each final deliverable.

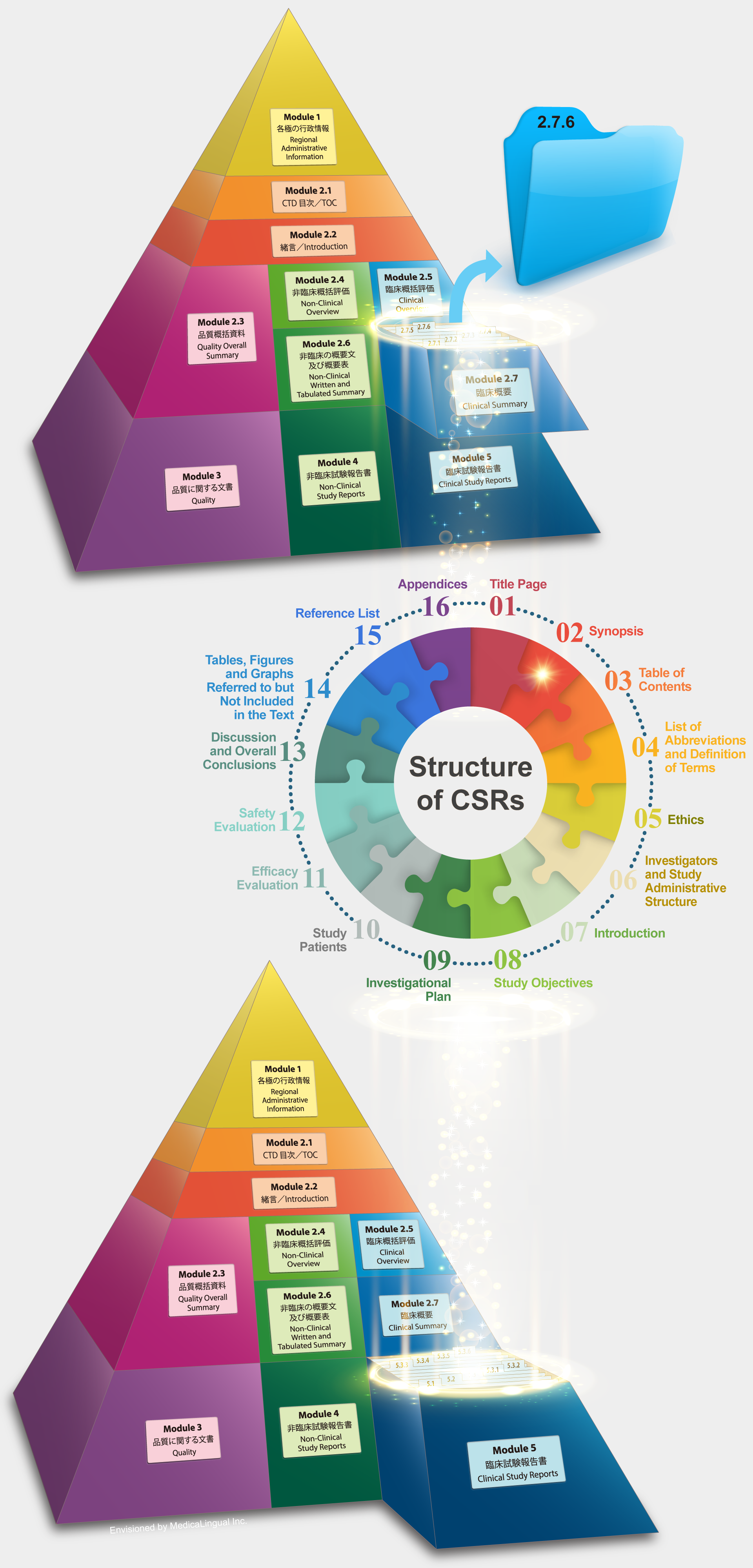
Module 2.7.6 の作成
Preparation of Module 2.7.6
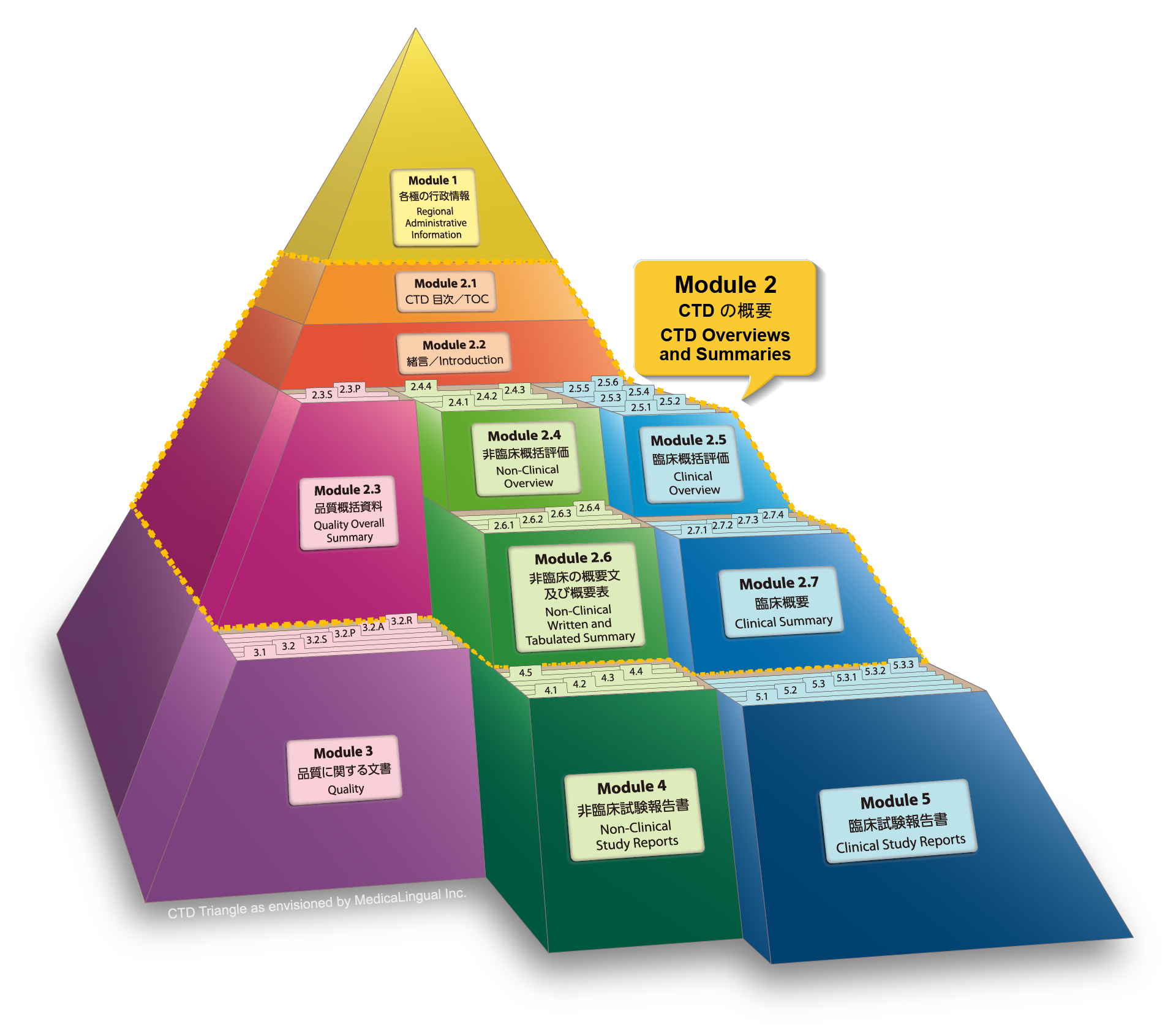
CTDの構成と内容
Structure and Content of CTD