メディカルライターと翻訳者のための
治験総括報告書の構成と内容 ― 薬審発第335号
注意事項:当サイトに掲載されたガイドラインは、メディカルライターや翻訳者の方々の参考用又は学習用に、PMDA情報提供ホームページから日英併記で引用したものです。レイアウトの都合上、省略した箇所もありますので、各ガイドラインの完全な情報については、必ずPMDA情報提供ホームページから取得してください。
Structure and Content of Clinical Study Reports
for Medical Writers and Translators ― ICH Guideline E3
Note: The guidelines on this website are quoted from the PMDA’s information website in both Japanese and English for the reference and study purposes of medical writers and translators. Some parts have been omitted due to the layout, so please be sure to obtain complete information on each guideline from the PMDA’s information website.
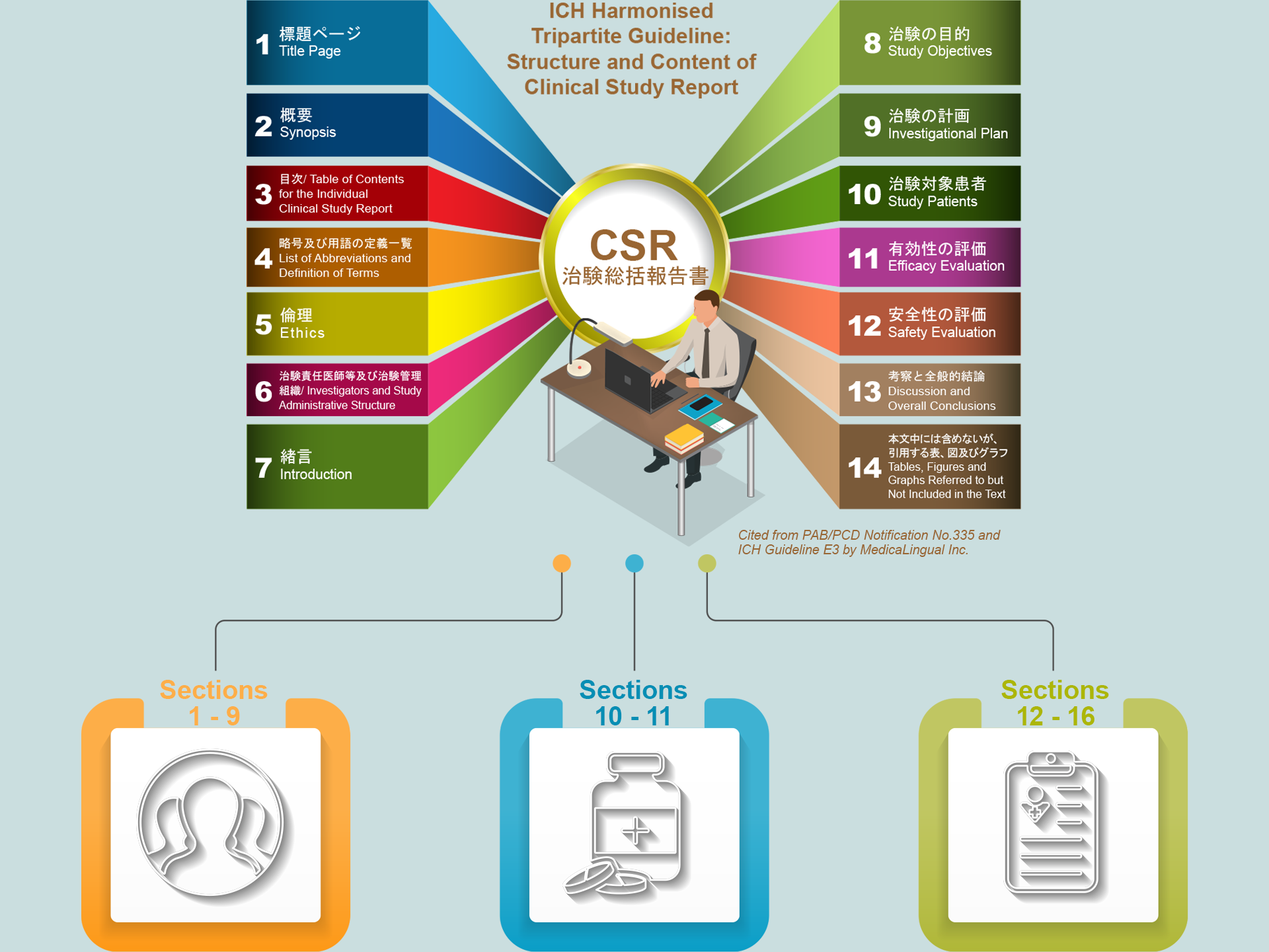
█ ガイドライン 序文/INTRODUCTION TO THE GUIDELINE
█ 3. 目次/TABLE OF CONTENTS FOR THE INDIVIDUAL CLINICAL STUDY REPORT
█ 4. 略号 及び用語の定義の一覧/LIST OF ABBREVIATIONS AND DEFINITION OF TERMS
█ 6. 治験責任医師等及び治験管理組織/INVESTIGATORS AND STUDY ADMINISTRATIVE STRUCTURE
█ 9. 治験の計画/INVESTIGATIONAL PLAN
9.1 治験の全般的デザイン及び計画-記述/OVERALL STUDY DESIGN AND PLAN – DESCRIPTION
9.2 対照群の選択を含む治験デザインについての考察/DISCUSSION OF STUDY DESIGN, INCLUDING THE CHOICE OF CONTROL GROUPS
9.3 治験対象集団の選択/SELECTION OF STUDY POPULATION
9.5 有効性及び安全性の項目/EFFICACY AND SAFETY VARIABLES
9.6 データの品質保証/DATA QUALITY ASSURANCE
9.8 治験の実施又は計画された解析に関する変更/CHANGES IN THE CONDUCT OF THE STUDY OR PLANNED ANALYSES
10.1 患者の内訳/DISPOSITION OF PATIENTS
10.2 治験実施計画書からの逸脱/PROTOCOL DEVIATIONS
█ 11. 有効性の評価/EFFICACY EVALUATION
11.1 解析したデータセット/DATA SETS ANALYSED
11.2 人口統計学的及び他の基準値の特性/DEMOGRAPHIC AND OTHER BASELINE CHARACTERISTICS
11.3 治療の遵守状況の測定/MEASUREMENTS OF TREATMENT COMPLIANCE
11.4 有効性に関する成績及び個別患者データ一覧表/EFFICACY RESULTS AND TABULATIONS OF INDIVIDUAL PATIENT DATA
11.4.1 有効性の解析/ANALYSIS OF EFFICACY
11.4.2 統計・解析上の論点/STATISTICAL/ANALYTICAL ISSUES
11.4.3 個別反応データの作表/TABULATION OF INDIVIDUAL RESPONSE DATA
11.4.4 薬剤の用量,薬物濃度及びそれらと反応との関係/DRUG DOSE, DRUG CONCENTRATION, AND RELATIONSHIPS TO RESPONSE
11.4.5 薬物―薬物及び薬物―疾患の相互作用/DRUG-DRUG AND DRUG-DISEASE INTERACTIONS
█ 12. 安全性の評価/SAFETY EVALUATION
12.1 治験薬が投与された被験者数,期間及び用量/EXTENT OF EXPOSURE
12.2 有害事象/ADVERSE EVENTS (AEs)
12.2.1 有害事象の簡潔な要約/BRIEF SUMMARY OF ADVERSE EVENTS)
12.2.2 有害事象の表示/DISPLAY OF ADVERSE EVENTS
12.2.3 有害事象の分析/ANALYSIS OF ADVERSE EVENTS
12.2.4 患者ごとの有害事象の一覧表/LISTING OF ADVERSE EVENTS BY PATIENT
12.4 臨床検査値の評価/CLINICAL LABORATORY EVALUATION
12.4.2 各臨床検査項目の評価/EVALUATION OF EACH LABORATORY PARAMETER
12.6 安全性の結論/SAFETY CONCLUSIONS
█ 13. 考察と全般的結論/DISCUSSION AND OVERALL CONCLUSIONS
█ 14. 本文中には含めないが,引用する表,図及びグラフ/TABLES, FIGURES AND GRAPHS REFERRED TO BUT NOT INCLUDED IN THE TEXT










