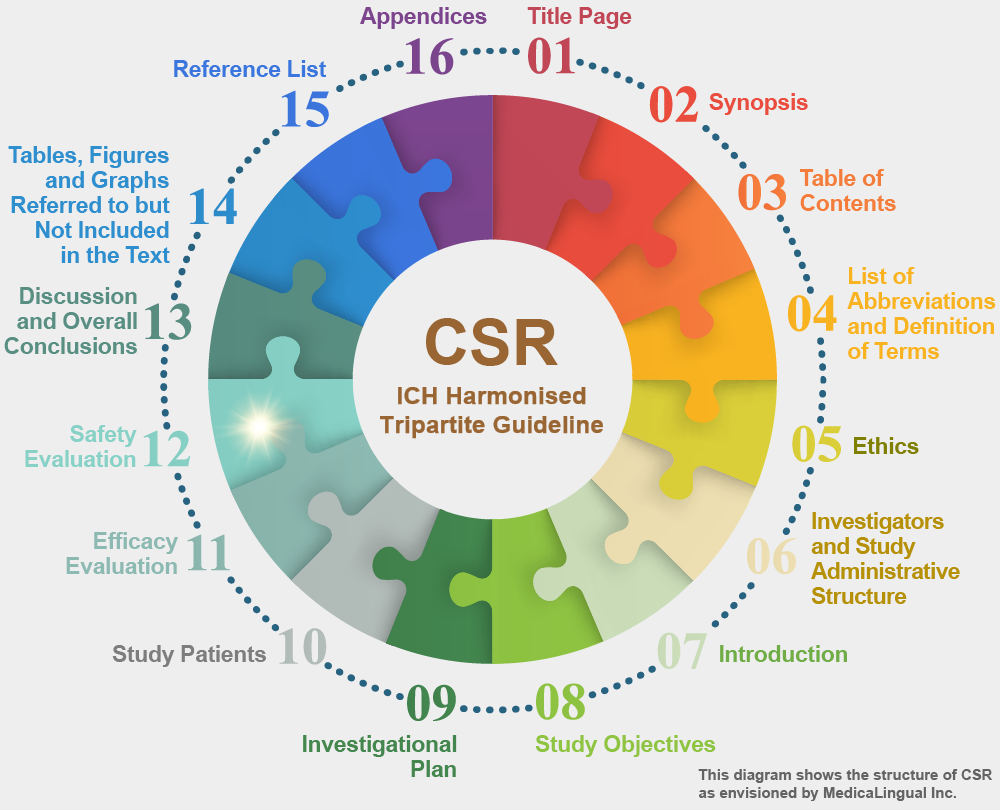
治験の統括報告書の構成と内容に関するガイドライン
平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
12. 安全性の評価
12.3 死亡,その他の重篤な有害事象及び他の重要な有害事象
死亡,他の重篤な有害事象及び他の重要な有害事象については特別な注意が必要である。
12. SAFETY EVALUATION
12.3 DEATHS, OTHER SERIOUS ADVERSE EVENTS, AND OTHER SIGNIFICANT ADVERSE EVENTS
Deaths, other serious adverse events, and other significant adverse events deserve special attention.
全ての略号や記号は,その一覧表の冒頭に,又はできれば各ページに説明すること。
Any abbreviations and codes should be clearly explained at the beginning of the listing or, preferably, on each page.










