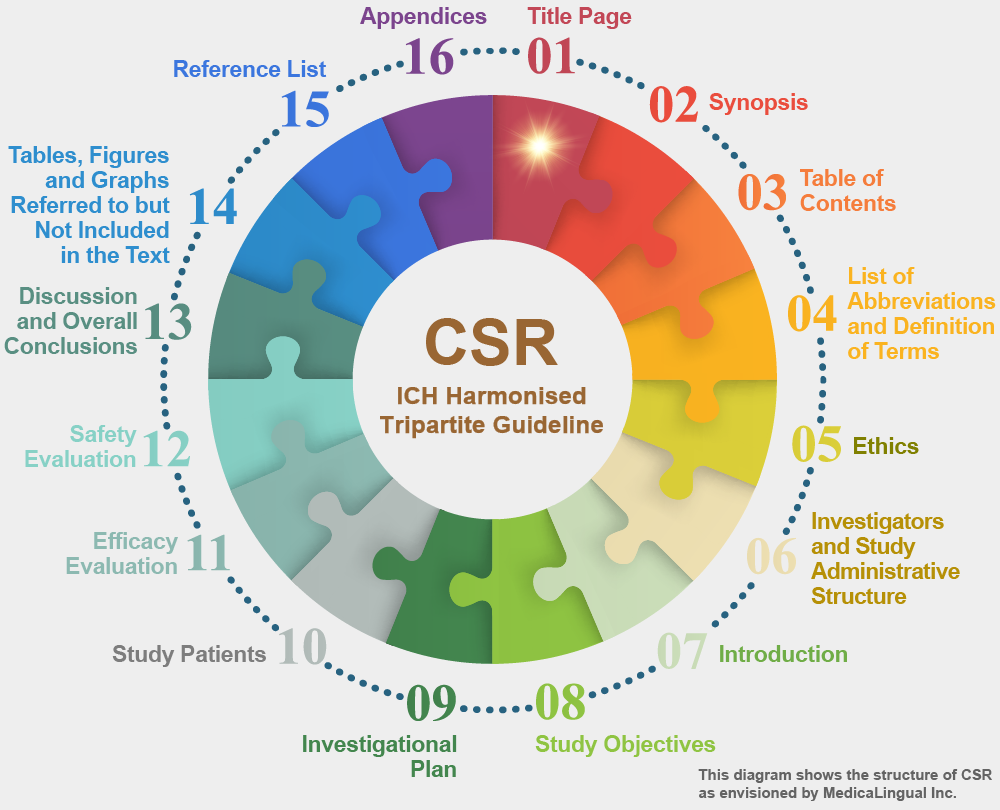
治験の統括報告書の構成と内容に関するガイドライン
平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
1. 標題ページ
標題ページには下記の情報を含めること。
-治験の標題
-被験薬名
-対象とした適応
-標題から明らかでない場合,デザイン(並行群間比較,クロスオーバー,盲検化,無作為化),比較(プラセボ,実薬,用量-反応),期間,用量及び患者母集団についての簡潔な(1,2行の)記述
-治験依頼者名
-治験実施計画書の識別コード(又は番号)
-開発のフェーズ
-治験開始日(最初の患者を組み入れた日又は照合可能な他の定義による日付)
-早期中止した治験であればその日付
-治験終了日(最終の患者が完了した日)
-治験総括(調整)医師又は治験依頼者の医学責任者の氏名と所属
-治験依頼者側の署名者の氏名(治験依頼者の総括報告書の責任者。審査中に総括報告書について発生する質問の窓口となる治験依頼者の担当者の氏名,電話番号,ファックス番号をこのページ又は申請書に示すこと。)
-必須文書の保管も含め,医薬品の臨床試験の実施に関する基準(GCP)に従って治験が実施されたことを示す陳述
-報告書の日付(標題と日付により,同一治験のそれ以前のいかなる報告書とも区別する.)
1. TITLE PAGE
The title page should contain the following information:
– study title
– name of test drug/ investigational product
– indication studied
– if not apparent from the title, a brief (1 to 2 sentences) description giving design (parallel, cross-over, blinding, randomised) comparison (placebo, active, dose/response), duration, dose, and patient population
– name of the sponsor
– protocol identification (code or number)
– development phase of study
– study initiation date (first patient enrolled, or any other verifiable definition)
– date of early study termination, if any
– study completion date (last patient completed)
– name and affiliation of principal or coordinating investigator(s) or sponsor’s responsible medical officer
– name of company/sponsor signatory (the person responsible for the study report within the company/sponsor. The name, telephone number and fax number of the company/sponsor contact persons for questions arising during review of the study report should be indicated on this page or in the letter of application.)
– statement indicating whether the study was performed in compliance with Good Clinical Practices (GCP), including the archiving of essential documents
– date of the report (identify any earlier reports from the same study by title and date).










