平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
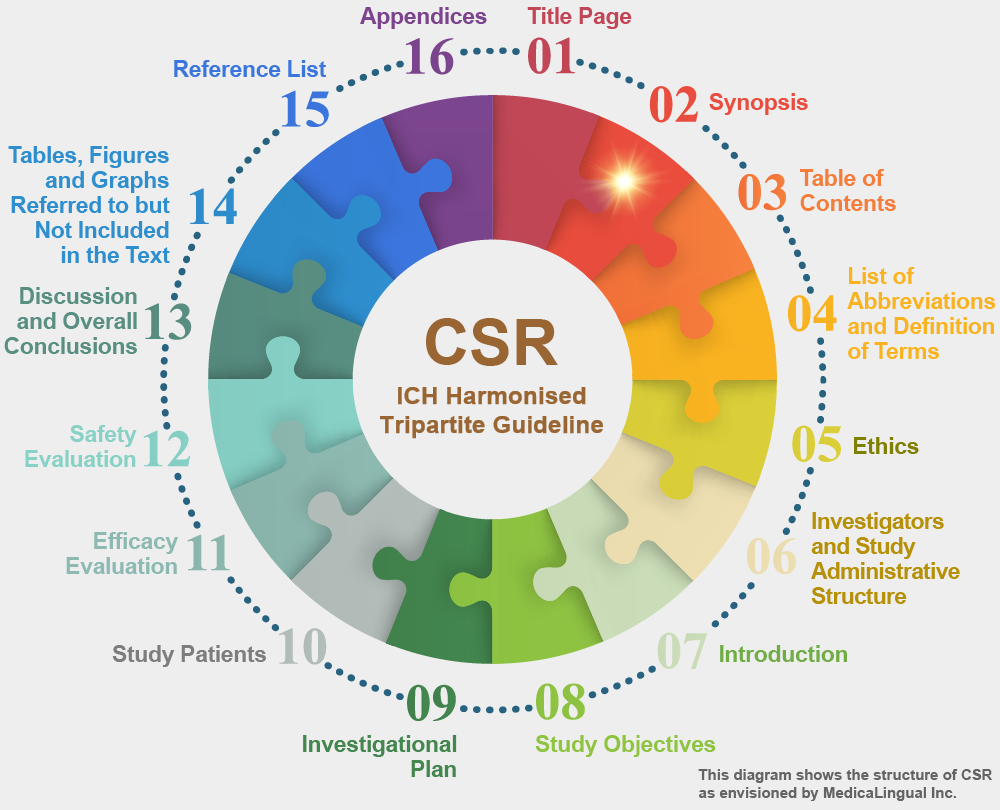
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
2. 概要
治験を要約する簡潔な概要(通常3ページ以内)を示すこと(欧州で用いられている概要様式の例として,本ガイドライン別添Ⅰを参照)。概要には,単に文章やp 値だけでなく,結果を説明するための数値データも含めること。
2. SYNOPSIS
A brief synopsis (usually limited to 3 pages) that summarises the study should be provided (see Annex I of the guideline for an example of a synopsis format used in Europe). The synopsis should include numerical data to illustrate results, not just text or p-values.










