平成8年5月1日 薬審第335号
各都道府県衛生主管部(局)長あて 厚生省薬務局審査課長通知
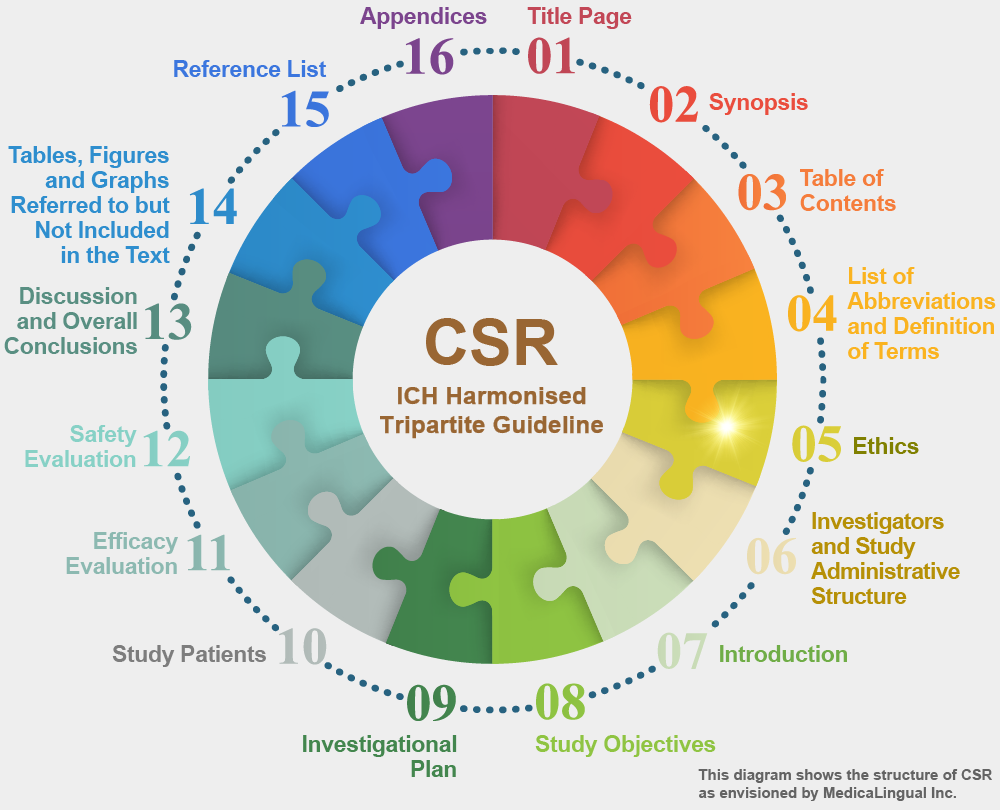
STRUCTURE AND CONTENT OF CLINICAL STUDY REPORTS
Recommended for Adoption at Step 4 of the ICH Process on 30 November 1995 by the ICH Steering Committee
5. 倫理
5.1 治験審査委員会(IRB)
治験実施計画及びその修正が,治験審査委員会により審査されたことを確認し,記載すること。審議を依頼した治験審査委員会の一覧(確認が行われた年月日,並びに委員の氏名及び職名)を付録16.1.3に添付すること。
5. ETHICS
5.1 INDEPENDENT ETHICS COMMITTEE (IEC) OR INSTITUTIONAL REVIEW BOARD (IRB)
It should be confirmed that the study and any amendments were reviewed by an Independent Ethics Committee or Institutional Review Board. A list of all IECs or IRBs consulted should be given in appendix 16.1.3 and, if required by the regulatory authority, the name of the committee Chair should be provided.
5.2 治験の倫理的実施
治験がヘルシンキ宣言に基づいた倫理原則に従って実施されたことを確認し,記載すること。
5.2 ETHICAL CONDUCT OF THE STUDY
It should be confirmed that the study was conducted in accordance with the ethical principles that have their origins in the Declaration of Helsinki.
5.3 患者への情報及び同意
インフォームド・コンセントが,患者の登録(例えば,割付け時,事前のスクリーニング時)との関係において,いつどのように得られたかを記載すること。
患者への説明文書や同意文書の見本を付録16.1.3に添付すること。
5.3 PATIENT INFORMATION AND CONSENT
How and when informed consent was obtained in relation to patient enrolment, (e.g., at allocation, pre-screening) should be described.
Representative written information for the patient (if any) and a sample patient consent form should be provided in appendix 16.1.3.










