薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
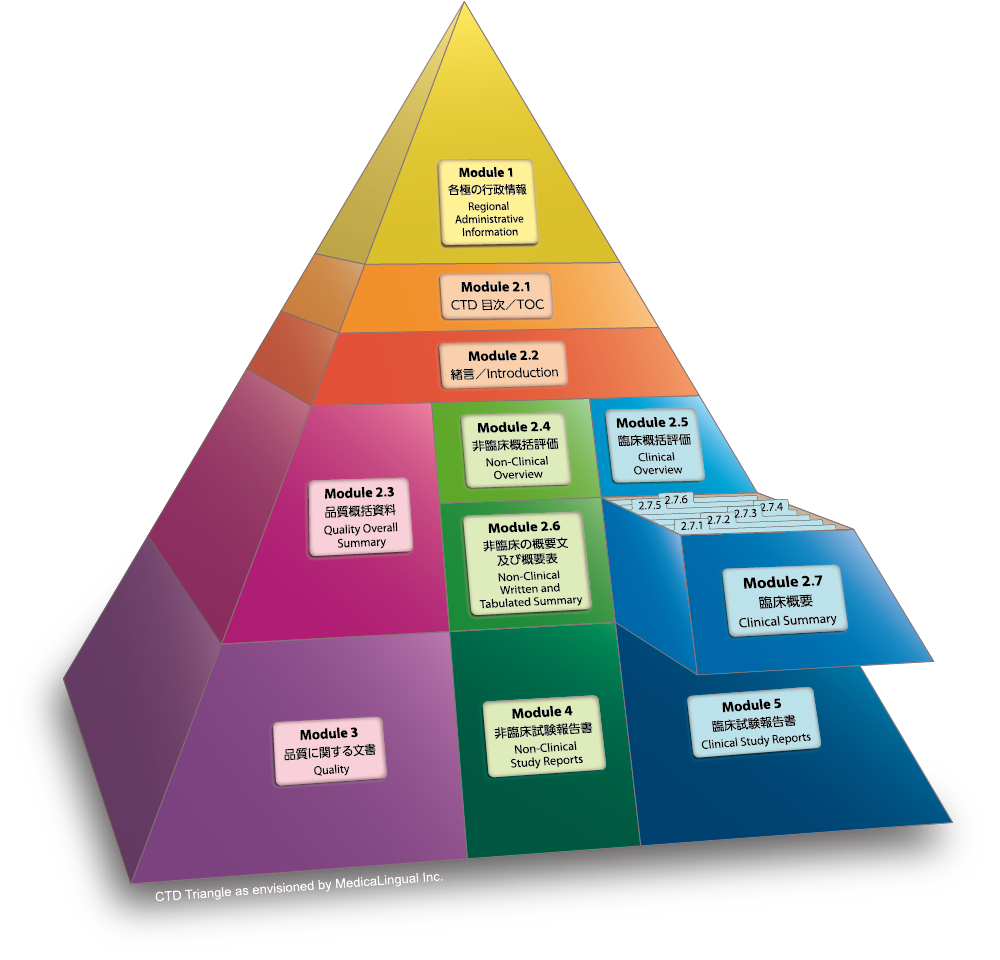
Module 2.7 臨床概要
序文
臨床概要の目的は、国際共通化資料(CTD)中の全ての臨床情報の詳細な事実に基づく要約を提供することである。これには、ICH E3 でいう「治験の総括報告書」から得られた情報、第 5 部に報告書一式が添付されている試験のメタアナリシスや複数試験にまたがる併合解析から得られた情報、他の地域で販売されている品目については市販後のデータが含まれる。本文書で提供される試験間の結果の比較及び解析は、事実に基づく観察・結果に重点を置くこと。対照的に、「臨床に関する概括評価」では、臨床において得られた情報についての考察と解釈、及び既存の治療法の中における当該医薬品の位置付けに関する考察を含め、臨床試験計画とその結果に関する重要な解 析を示すこと。
臨床概要の長さは伝達すべき情報により変わるが、付表を除き通常 50 ページから 400 ページの範囲と想定されている。
Module 2.7 CLINICAL SUMMARY
Preamble
The Clinical Summary is intended to provide a detailed, factual summarisation of all of the clinical information in the Common Technical Document. This includes information provided in ICH E3 clinical study reports; information obtained from any meta-analyses or other cross-study analyses for which full reports have been included in Module 5; and postmarketing data for products that have been marketed in other regions. The comparisons and analyses of results across studies provided in this document should focus on factual observations. In contrast, the CTD Clinical Overview document should provide critical analysis of the clinical study program and its results, including discussion and interpretation of the clinical findings and discussion of the place of the test drug in the armamentarium.
The length of the Clinical Summary will vary substantially according to the information to be conveyed, but it is anticipated that (excluding attached tables) the Clinical Summary will usually be in the range of 50 to 400 pages.










