薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
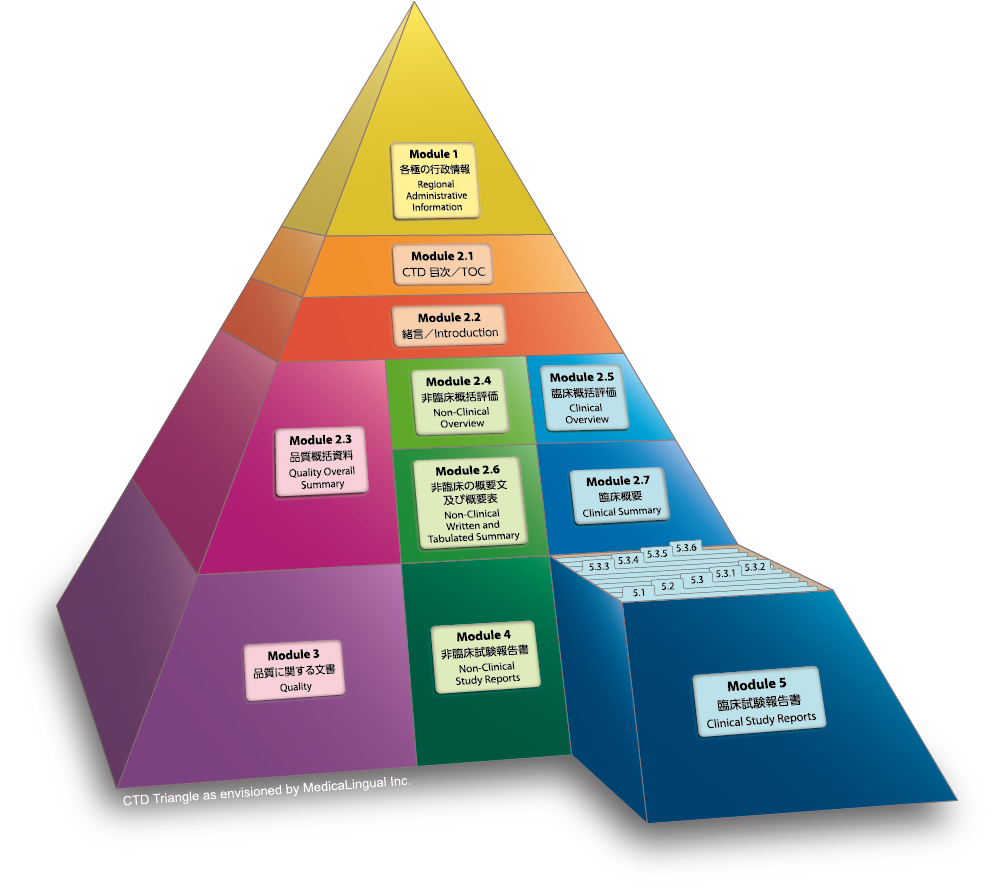
Module 5 臨床試験報告書
序文
「治験の総括報告書の構成と内容に関するガイドライン(E3)」が公表されているが、この第5部では、医薬品承認申請のための国際共通化資料(CTD)における総括報告書、その他臨床データ及び参考文献の配列に関する指針を示すものである。これらCTD資料の配列は、承認申請書類の作成及び当局による審査を容易にするものである。
このガイドラインは、臨床試験報告書の配列を示すものであり、承認取得のためにどのような試験が要求されるのかを示すものではない。
Module 5 CLINICAL STUDY REPORTS
Preamble
Through the ICH process, a guideline has been published on the structure and content of clinical study reports (E3). This document provides guidance on the organisation of these study reports, other clinical data, and references within a Common Technical Document (CTD) for registration of a pharmaceutical product for human use. These elements should facilitate the preparation and review of a marketing application.
This guideline is not intended to indicate what studies are required for successful registration. It indicates an appropriate organization for the clinical study reports that are in the application.
第 5 部(モジュール 5)における臨床試験報告書 及び関連情報の詳細な配列
本ガイドラインは、承認申請書類の作成とその審査が円滑に行われるよう、また資料を完全なものにするため、臨床試験報告書及び関連情報の一定の配列を推奨するものである。報告書の配列は、主たる試験目的によって決めること。各報告書は一つの項のみに添付し、複数目的の場合は、添付を繰返さずその項を参照すること。添付する報告書又は情報がない項目には、「該当せず」又は「試験を実施せず」等と記載すること。
Detailed Organisation of Clinical Study Reports and Related Information in Module 5.
This guideline recommends a specific organization for the placement of clinical study reports and related information to simplify preparation and review of dossiers and to ensure completeness. The placement of a report should be determined by the primary objective of the study. Each study report should appear in only one section. Where there are multiple objectives, the study should be cross-referenced in the various sections. An explanation such as “not applicable” or “no study conducted” should be provided when no report or information is available for a section or subsection.










