薬生薬審発0202第1号(平成29年2月2日)
ICH HARMONISED GUIDELINE- M4E(R2) – Dated 15 June 2016
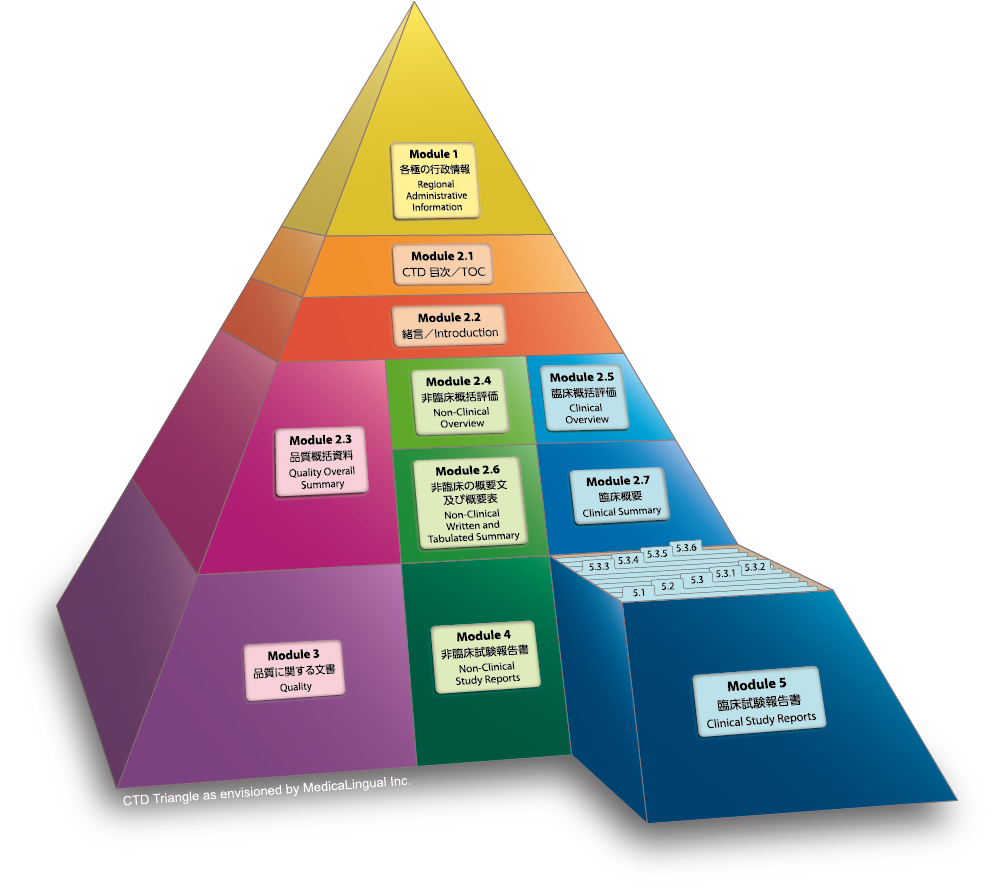
Module 5 臨床試験報告書
5.3 試験報告書及び関連情報
5.3.4 臨床薬力学(PD) 試験報告書
ヒトにおける医薬品のPD作用を検討することを主目的とする試験の報告書は、本項に添付すること。しかし、有効性の確立や、安全性データの集積が主目的である場合には、第5.3.5項に添付すること。
Module 5 CLINICAL STUDY REPORTS
5.3 Clinical Study Reports
5.3.4 Reports of Human Pharmacodynamic (PD) Studies
Reports of studies with a primary objective of determining the PD effects of a drug product in humans should be placed in this section. Reports of studies whose primary objective is to establish efficacy or to accumulate safety data, however, should be placed in Section 5.3.5.
本項の対象となる試験には、(1)期待される臨床効果と関連するか関連すると考えられる薬理学的特性(生物学的マーカー)に関する試験、(2)主たる臨床的効果を検討する短期試験、(3)期待される臨床効果と関連しないその他の特性に関するPD試験等がある。薬理学的効果と用量ないし血漿中薬物/代謝物濃度との定量的関係については、通常関心のあるところであり、PD関連情報は、用量反応試験あるいはPK試験(濃度-反応又はPK/PD試験)における薬物濃度に関する情報と共に得られることが多い。適切に管理された試験から得られたものではないPKとPD作用との関係は、しばしばモデルを用いて評価され、用量反応試験のデザインの根拠として、時に、部分集団における薬物濃度の違いの影響を解釈する根拠として利用される。
This section should include reports of 1) studies of pharmacologic properties known or thought to be related to the desired clinical effects (biomarkers), 2) short-term studies of the main clinical effect, and 3) PD studies of other properties not related to the desired clinical effect. Because a quantitative relationship of these pharmacological effects to dose and/or plasma drug and metabolite concentrations is usually of interest, PD information is frequently collected in dose response studies or together with drug concentration information in PK studies (concentration-response or PK/PD studies). Relationships between PK and PD effects that are not obtained in well-controlled studies are often evaluated using an appropriate model and used as a basis for designing further dose-response studies or, in some cases, for interpreting effects of concentration differences in population subsets.
用量探索試験、PD試験、PK-PD試験は、健康被験者及び/又は患者を対象に実施されるが、それらの試験を、ある適応症を対象に行う安全性及び有効性試験に組み入れることもできる。健康被験者で実施されたこれらの試験報告書は第5.3.4.1項に、患者で実施された報告書は第5.3.4.2項に添付すること。
Dose-finding, PD and/or PK-PD studies can be conducted in healthy subjects and/or patients, and can also be incorporated into the studies that evaluate safety and efficacy in a clinical indication. Reports of dose-finding, PD and/or PK/PD studies conducted in healthy subjects should be placed in Section 5.3.4.1, and the reports for those studies conducted in patients should be placed in Section 5.3.4.2.
患者におけるPD試験で得られる短期PD、用量探索、PK-PDに関する情報には、受け入れられる代用マーカー(例:血圧)や治療上のベネフィットを示すエンドポイント(例:疼痛の緩和)に対する効果を反映するものもあるため、有効性評価に寄与するデータを提供する場合もある。同様に、PD試験が重要な安全性情報を含むこともある。ゆえに、PD試験のうち有効性や安全性を証明するものがあれば、その試験は有効性及び安全性試験とみなし、第5.3.4項ではなく第5.3.5項に添付すること。
In some cases, the short-term PD, dose-finding, and/or PK-PD information found in pharmacodynamic studies conducted in patients will provide data that contribute to assessment of efficacy, either because they show an effect on an acceptable surrogate marker (e.g., blood pressure) or on a clinical benefit endpoint (e.g., pain relief). Similarly, a PD study may contain important clinical safety information. When these studies are part of the efficacy or safety demonstration, they are considered clinical efficacy and safety studies that should be included in Section 5.3.5, not in Section 5.3.4.
5.3.4.1 健康被験者におけるPD試験及びPK/PD試験報告書
健康被験者を対象とした、治療を目的としないPD試験、PK/PD試験は、本項に添付すること。
5.3.4.1 Healthy Subject PD and PK/PD Study Reports
PD and/or PK/PD studies having non-therapeutic objectives in healthy subjects should be placed in this section.
5.3.4.2 患者におけるPD試験及びPK/PD試験報告書
患者を対象としたPD試験、PK/PD試験は、本項に添付すること。
5.3.4.2 Patient PD and PK/PD Study Reports
PD and/or PK/PD studies in patients should be submitted in this section.










