医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
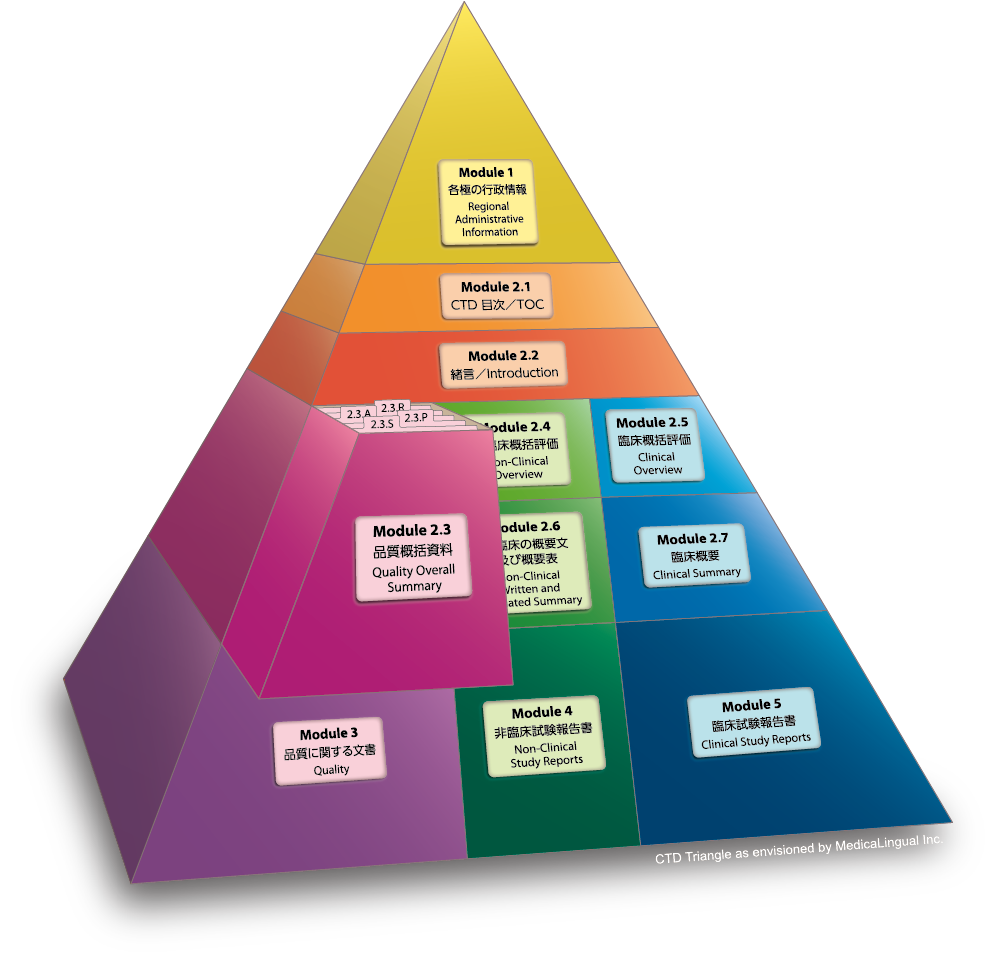
Module 2.3 品質に関する概括資料
2.3.P 製剤
2.3.P.1 製剤及び処方
3.2.P.1 の記載内容を示す。
3.2.P.1 記載の処方を示す。
Module 2.3 QUALITY OVERALL SUMMARY
2.3.P Drug Product
2.3.P.1 Description and Composition of the Drug
Information from 3.2.P.1 should be provided.
Composition from 3.2.P.1 should be provided.
2.3.P.2 製剤開発の経緯
3.2.P.2 記載内容及びデータに関する考察を示す。
必要に応じ、臨床試験に用いられた各処方の組成及びその溶出特性の一覧表を示す。
2.3.P.2 Pharmaceutical Development
A discussion of the information and data from 3.2.P.2 should be presented.
A tabulated summary of the composition of the formulations used in clinical trials and a presentation of dissolution profiles should be provided, where relevant.
2.3.P.3 製造
- 3.2.P.3 記載の以下の事項を示す。
- 製造業者に関する記述
- 適正な品質の製剤を恒常的に製造するための製造工程及びその管理に関する概略
- 3.2.P.3.3 に示す流れ図。
- 3.2.P.3.5 記載のプロセス・バリデーション/プロセス評価の簡潔な記述
2.3.P.3 Manufacture
Information from 3.2.P.3 should include:
- Information on the manufacturer.
- A brief description of the manufacturing process and the controls that are intended to result in the routine and consistent production of product of appropriate quality.
- A flow diagram, as provided under 3.2.P.3.3.
- A brief description of the process validation and/or evaluation, as described in 3.2.P.3.5.
2.3.P.4 添加剤の管理
3.2.P.4 記載の添加剤の品質に関する簡潔な要約を示す。
2.3.P.4 Control of Excipients
A brief summary on the quality of excipients, as described in 3.2.P.4, should be included.
2.3.P.5 製剤の管理
規格及び試験方法の妥当性についての簡潔な要約、試験方法、その分析法バリデーション及び不純物の特性の要約を示す。
3.2.P.5.1 記載の規格及び試験方法を示す。
3.2.P.5.4 記載のロット分析の表形式のまとめ。適宜、図示。
2.3.P.5 Control of Drug Product
A brief summary of the justification of the specification(s), a summary of the analytical procedures and validation, and characterisation of impurities should be provided.
Specification(s) from 3.2.P.5.1 should be provided.
A tabulated summary of the batch analyses provided under 3.2.P.5.4, with graphical representation where appropriate should be included.
The post-approval stability protocol, as described in 3.2.P.8.2, should be provided.
2.3.P.6 標準品及び標準物質
3.2.P.6 の記載事項について、適宜、表にして示す。
2.3.P.6 Reference Standards or Materials
Information from 3.2.P.6 (tabulated presentation, where appropriate) should be included.
2.3.P.7 容器及び施栓系
3.2.P.7 の記載内容について、簡潔な記述と考察を行う。
2.3.P.7 Container Closure System
A brief description and discussion of the information in 3.2.P.7 should be included.
2.3.P.8 安定性
実施した試験の要約(条件、ロット、試験方法)、試験結果及びデータ解析についての簡潔な考察並びに結論を示す。貯蔵方法、有効期間、適宜、使用時の保存条件及び有効期間に関する結論を示す。
3.2.P.8.3 記載の安定性試験結果の表形式のまとめ。適宜、図示。
3.2.P.8.2 記載の承認後の安定性試験計画を示す。
2.3.P.8 Stability
A summary of the studies undertaken (conditions, batches, analytical procedures) and a brief discussion of the results and conclusions of the stability studies and analysis of data should be included. Conclusions with respect to storage conditions and shelf-life and, if applicable, in-use storage conditions and shelf-life should be given.
A tabulated summary of the stability results from 3.2.P.8.3, with graphical representation where appropriate, should be included.
The post-approval stability protocol, as described in 3.2.P.8.2, should be provided.










