医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
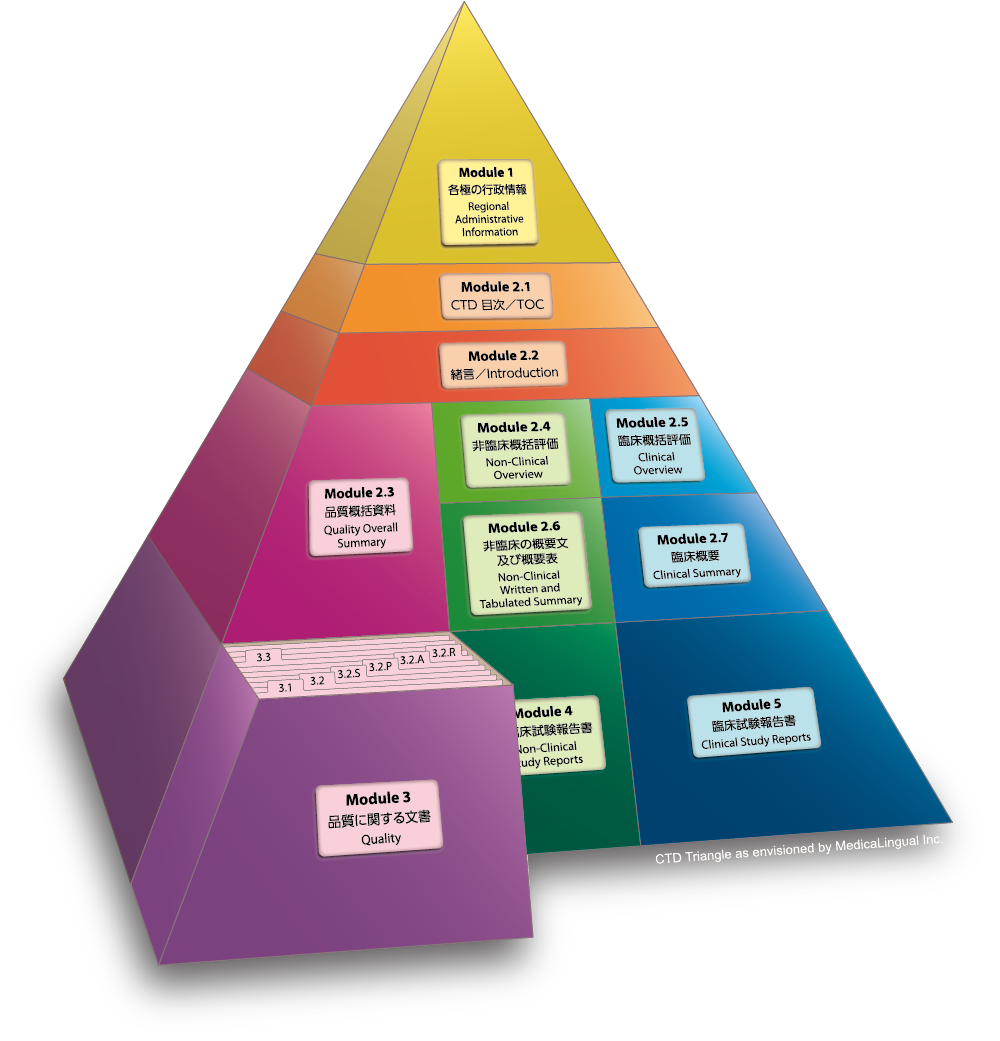
Module 3 品質に関する文書
3.2 データ
3.2.S 原薬
複数の原薬を含む製剤にあっては、各原薬ごとに3.2.S項の資料を作成する。
Module 3 QUALITY
3.2 Body of Data
3.2.S Drug Substance
For a drug product containing more than one drug substance, the information requested for part “S” should be provided in its entirety for each drug substance.
3.2.S.5 標準品又は標準物質
原薬の試験に用いられる標準品又は標準物質について記述する。
参照ICHガイドラインQ6A及びQ6B
3.2.S.5 Reference Standards or Materials
Information on the reference standards or reference materials used for testing of the drug substance should be provided.
Reference ICH Guidelines: Q6A and Q6B










