医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
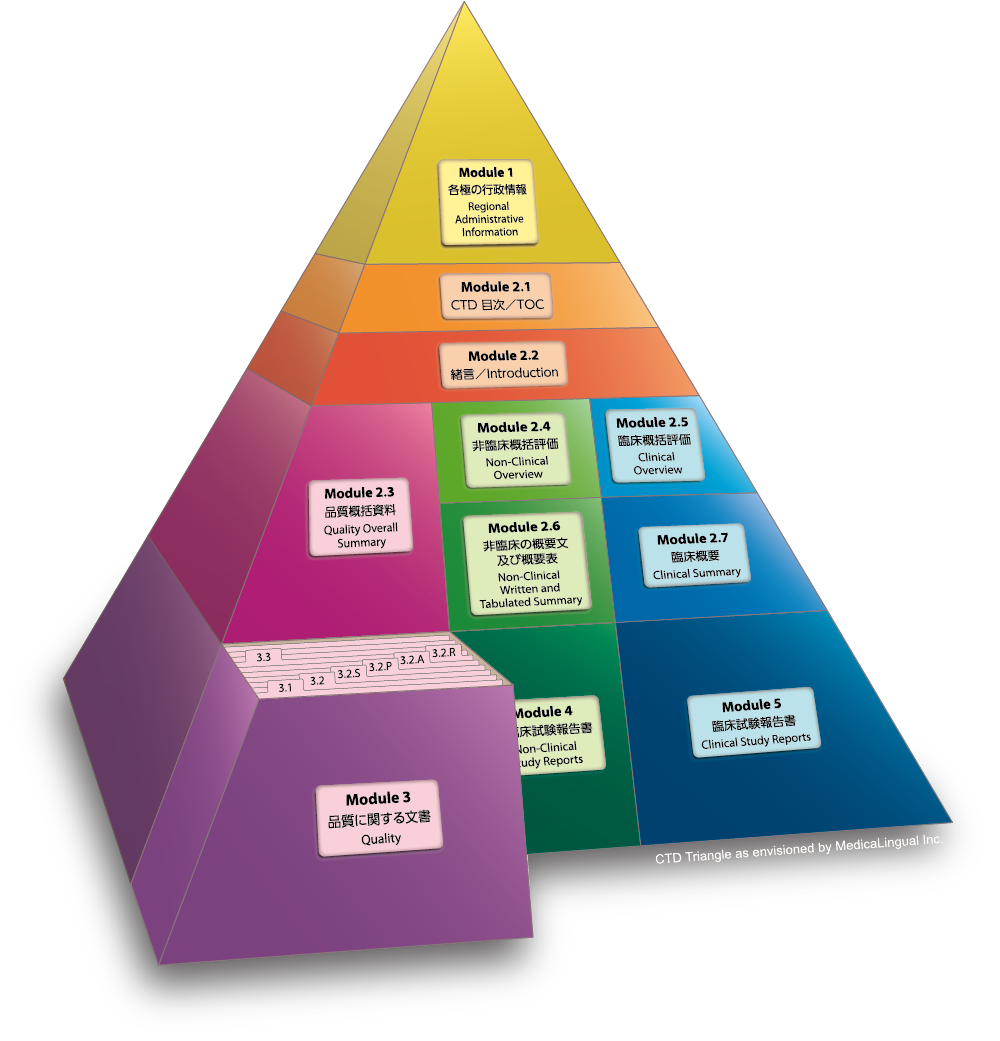
Module 3 品質に関する文書
3.2 データ
3.2.S 原薬
複数の原薬を含む製剤にあっては、各原薬ごとに3.2.S項の資料を作成する。
Module 3 QUALITY
3.2 Body of Data
3.2.S Drug Substance
For a drug product containing more than one drug substance, the information requested for part “S” should be provided in its entirety for each drug substance.
3.2.S.7 安定性
3.2.S.7.1 安定性のまとめ及び結論
実施された試験の種類、試験計画及び試験結果の要約を示す。苛酷試験、加速試験等の結果を含める。保存条件に関する結論及び必要に応じてリテスト期間又は有効期間に関する結論をまとめる。
参照ICHガイドラインQ1A、Q1B及びQ5C
3.2.S.7 Stability
3.2.S.7.1 Stability Summary and Conclusions
The types of studies conducted, protocols used, and the results of the studies should be summarized. The summary should include results, for example, from forced degradation studies and stress conditions, as well as conclusions with respect to storage conditions and retest date or shelf-life, as appropriate.
Reference ICH Guidelines: Q1A, Q1B, and Q5C
3.2.S.7.2 承認後の安定性試験計画の作成及び実施
承認後の安定性試験計画及び試験データの取扱い方を明らかにしておくこと。
参照ICHガイドラインQ1A及びQ5C
3.2.S.7.2 Post-approval Stability Protocol and Stability Commitment
The post-approval stability protocol and stability commitment should be provided.
Reference ICH Guidelines: Q1A and Q5C
3.2.S.7.3 安定性データ
表、グラフ、文章等適切な方法で安定性試験(苛酷試験、加速試験等)の結果を示すこと。分析方法及びそのバリデーションについても記述する。
参照ICHガイドラインQ1A、Q1B、Q2A、Q2B及びQ5C
3.2.S.7.3 Stability Data
Results of the stability studies (e.g., forced degradation studies and stress conditions) should be presented in an appropriate format such as tabular, graphical, or narrative. Information on the analytical procedures used to generate the data and validation of these procedures should be included.
Reference ICH Guidelines: Q1A, Q1B, Q2A, Q2B, and Q5C










