医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
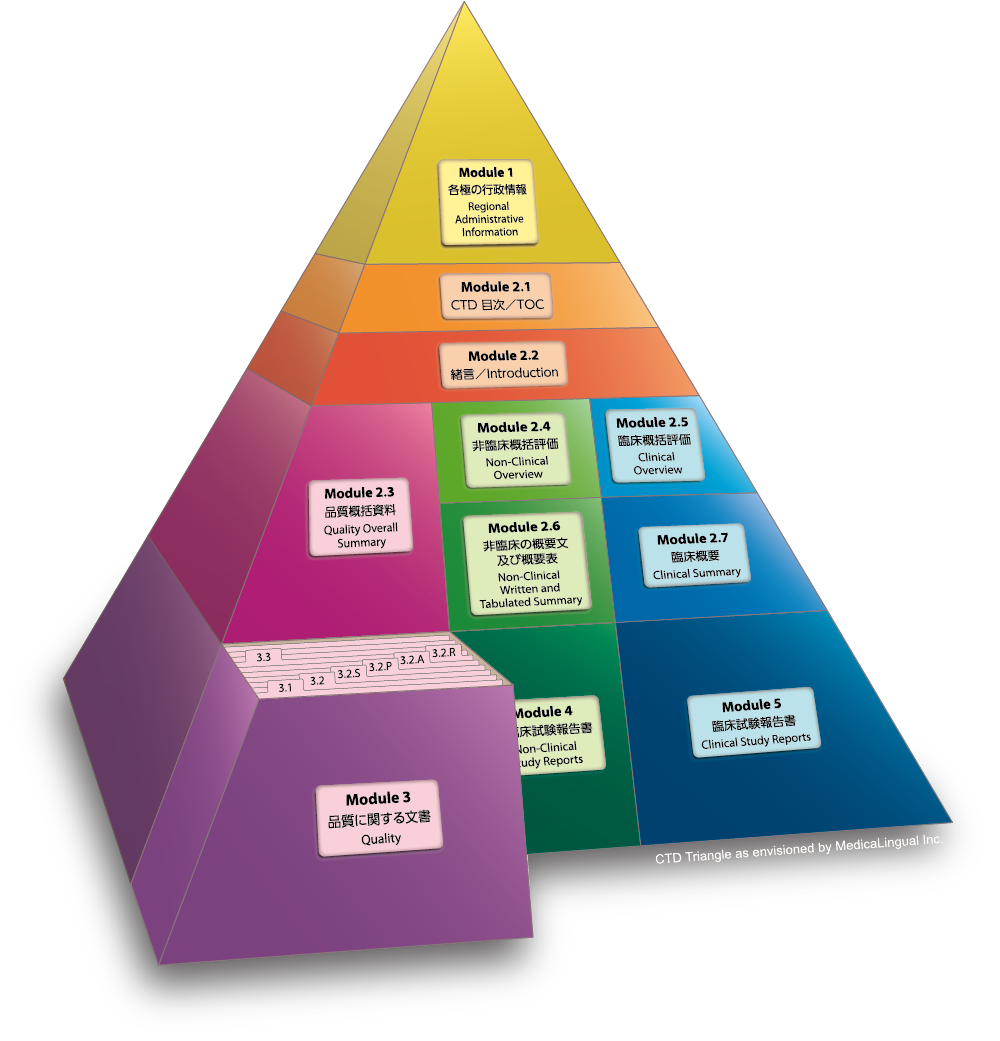
Module 3 品質に関する文書
3.2 データ
3.2.P 製剤
3.2.P.1 製剤及び処方
製剤及びその処方について記述する。記述する事項の例は次のとおりである。
- 剤型
- 成分分量、すなわち、剤型中の全成分の一覧、単位当たりの分量(過量仕込みがあれば、それを含む。)、配合目的及び準拠すべき品質規格/基準(公定書各条によるのか自社規格及び試験方法等によるのか)を記述する。
- 添付溶解液
- 製剤及び添付溶解液に使用する容器及び施栓系の種類を適宜、記述する。
参照ICHガイドラインQ6A及びQ6B
Module 3 QUALITY
3.2 Body of Data
3.2.P Drug Product
3.2.P.1 Description and Composition of the Drug Product
A description of the drug product and its composition should be provided. The information provided should include, for example:
- Description* of the dosage form;
- Composition, i.e., list of all components of the dosage form, and their amount on a per unit basis (including overages, if any) the function of the components, and a reference to their quality standards (e.g., compendial monographs or manufacturer’s specifications)
- Description of accompanying reconstitution diluent(s); and
- Type of container and closure used for the dosage form and accompanying reconstitution diluent, if applicable.
Reference ICH Guidelines: Q6A and Q6B
* For a drug product supplied with reconstitution diluent(s), the information on the diluent(s) should be provided in a separate part “P”, as appropriate










