医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
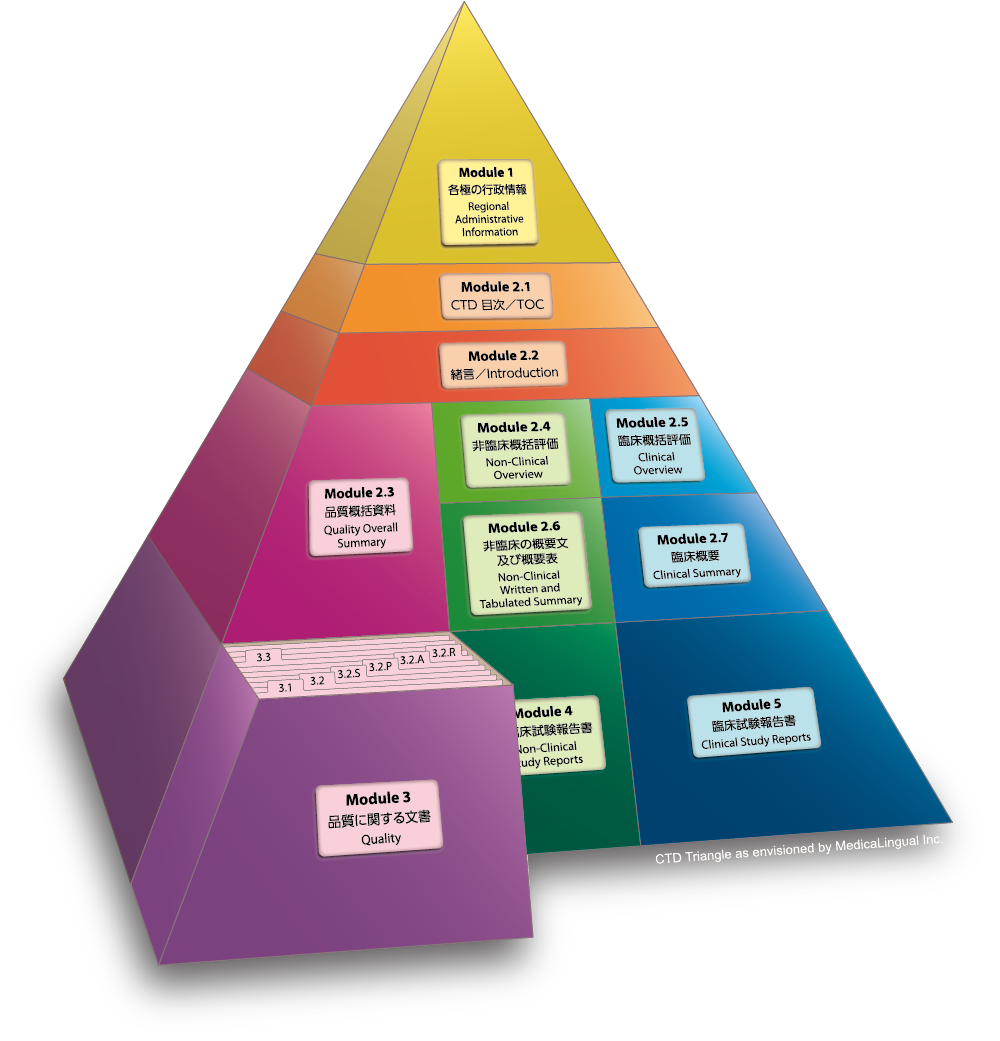
Module 3 品質に関する文書
3.2 データ
3.2.P 製剤
3.2.P.7 容器及び施栓系
容器及び施栓系について、一次包装を構成する各素材を明らかにすることを含め、記述する。また、容器及び施栓系の規格及び試験方法を記述する。規格及び試験方法には外観・性状及び確認試験(その他、重要と思われるものについては、適宜、寸法を図示すること)が含まれる。試験方法については、必要に応じて、公定書にない試験方法を含め、そのバリデーションとともに示すこと。
機能を有しない二次包装材(例えば、追加保護機能のないもの、製剤の輸送に関与しないもの等)については、外観・形状に関する簡潔な記述のみでよい。機能を有する二次包装材については、追加される機能に関して記述する。
容器及び施栓系の適格性については3.2.P.2 に記述する。
Module 3 QUALITY
3.2 Body of Data
3.2.P Drug Product
3.2.P.7 Container Closure System
A description of the container closure systems should be provided, including the identity of materials of construction of each primary packaging component and its specification. The specifications should include description and identification (and critical dimensions, with drawings where appropriate). Non-compendial methods (with validation) should be included where appropriate.
For non-functional secondary packaging components (e.g., those that neither provide additional protection nor serve to deliver the product), only a brief description should be provided. For functional secondary packaging components, additional information should be provided.
Suitability information should be located in 3.2.P.2.










