医薬審発第899号 CTD通知(別紙 3)
CTD-品質に関する文書の作成要領に関するガイドライン
(2002年9月11-12日ワシントン会議修正版)
ICH HARMONISED GUIDELINE
QUALITY – M4Q –
(Numbering and Section Headers have been edited for consistency and use in e-CTD as agreed at the Washington DC Meeting, September 11-12, 2002)
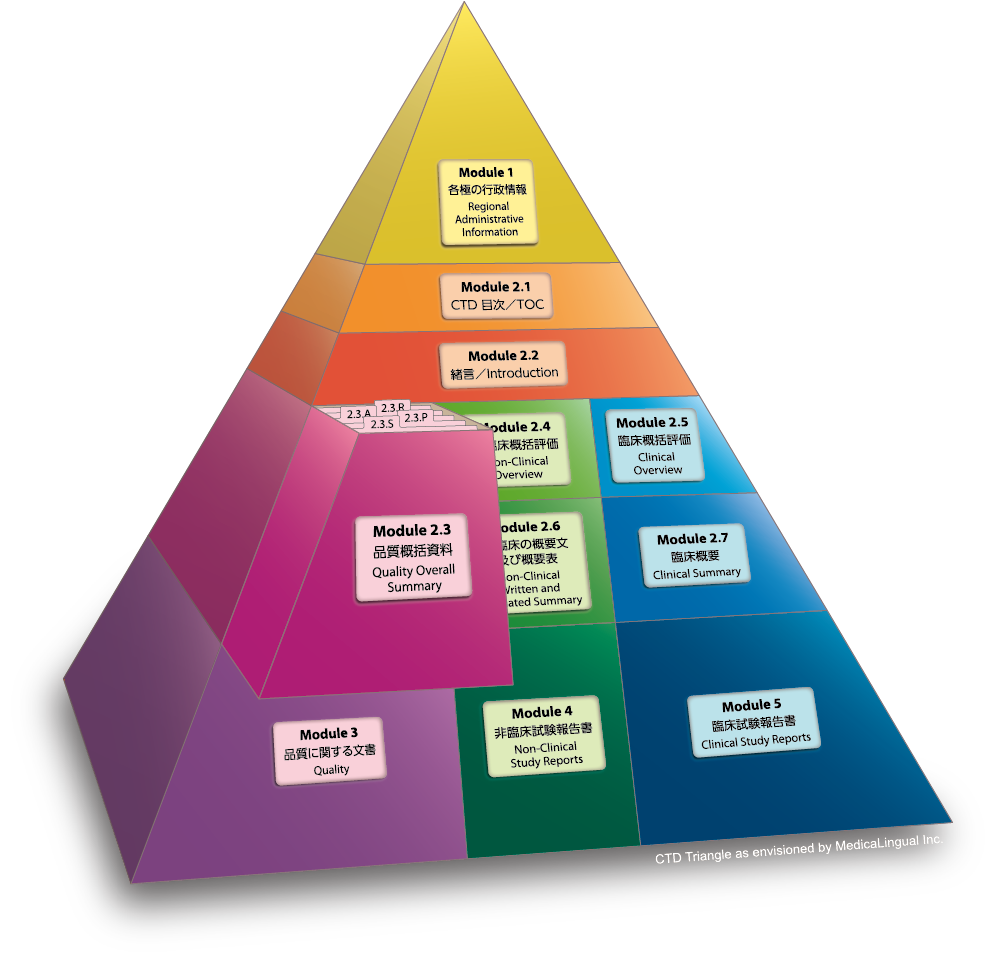
Module 2.3 品質に関する概括資料
2.3.S 原薬
2.3.S.1 一般情報
3.2.S.1 記載の事項
Module 2.3 QUALITY OVERALL SUMMARY
2.3.S Drug Substance
2.3.S.1 General Information
Information from 3.2.S.1 should be included.
2.3.S.2 製造
3.2.S.2 記載の事項について以下の要素を勘案して記述する。
- 製造業者に関する記述
- 適正な品質の原薬を恒常的に製造するための製造工程(出発物質、重要工程、再加工についての記述等を含む)及びその管理に関する概略
- 3.2.S.2.2 に示す流れ図
- 3.2.S.2.3 記載の原薬製造に係る出発物質及び生物起源の原料の記述
- 重要工程の選択、プロセス・コントロール並びに規格値/判定基準と、その妥当性に関する考察。特に、3.2.S.2.4 記載の重要中間体については記述する。
- 3.2.S.2.5 記載のプロセス・バリデーション/プロセス評価の記述
- 3.2.S.2.6 記載の開発過程における製造方法の重大な変更に関する簡潔な要約及び製品の同等・同質性を評価するための検討結果に基づく結論。製造方法の変更後のロットを使用した非臨床試験や臨床試験結果については、申請資料の非臨床試験や臨床試験を記載した箇所との相互参照ができるようにする。関する概括資料(以下「QOS」という。)は、第3部の資料をその範囲及び構成に即して要約したものである。QOSには、第3部(モジュール3)及びCTDの他の部分に含まれていない事項、データ及び考察を加えてはならない。
2.3.S.2 Manufacture
Information from 3.2.S.2 should be included:
- Information on the manufacturer;
- A brief description of the manufacturing process (including, for example, reference to starting materials, critical steps, and reprocessing) and the controls that are intended to result in the routine and consistent production of material(s) of appropriate quality;
- A flow diagram, as provided in 3.2.S.2.2;
- A description of the Source and Starting Material and raw materials of biological origin used in the manufacture of the drug substance, as described in 3.2.S.2.3;
- A discussion of the selection and justification of critical manufacturing steps, process controls, and acceptance criteria. Highlight critical process intermediates, as described in 3.2.S.2.4;
- A description of process validation and/or evaluation, as described in 3.2.S.2.5.
- A brief summary of major manufacturing changes made throughout development and conclusions from the assessment used to evaluate product consistency, as described in 3.2.S.2.6. The QOS should also cross-refer to the non-clinical and clinical studies that used batches affected by these manufacturing changes, as provided in the CTD-S and CTD-E modules of the dossier.
2.3.S.3 特性
- 新規化学薬品:
-3.2.S.3.1 記載の構造及び異性体に関する資料の概略。
-原薬が光学活性体であるときは、非臨床試験や臨床試験に使われたものが立体異性体のどちらか一方か、又は立体異性体の混合物であるかを示すとともに、市販のための製剤に使用される原薬の立体異性体の情報を示す。
2.3.S.3 Characterisation
- For NCE:
– A summary of the interpretation of evidence of structure and isomerism, as described in 3.2.S.3.1, should be included.
– When a drug substance is chiral, it should be specified whether specific stereoisomers or a mixture of stereoisomers have been used in the nonclinical and clinical studies, and information should be given as to the stereoisomer of the drug substance that is to be used in the final product intended for marketing.
- 生物薬品:
-3.2.S.3.1 記載の目的物質及び目的物質関連物質の記述と、一般的性質、特性及び特性解析データ(一次及び高次構造、生物活性等)の要約を示す。
- For Biotech:
– A description of the desired product and product-related substances and a summary of general properties, characteristic features and characterisation data (for example, primary and higher order structure and biological activity), as described in 3.2.S.3.1, should be included.
- 新規化学薬品及び生物薬品:
-合成過程、製造過程あるいは変化・分解等によって生じる可能性がある不純物及び実際に検出された不純物に関するデータを要約するとともに、個別の不純物及び不純物全体について規格値/判定基準を設定するための根拠を要約する。非臨床試験・臨床試験に供されたロットと市販製造しようとする工程で製造された典型的なロットの不純物レベルについて比較考察する。不純物の設定限度値の妥当性について述べる。
-3.2.S.3.2 記載のデータの表形式のまとめ。適宜、図示。
- For NCE and Biotech:
– The QOS should summarise the data on potential and actual impurities arising from the synthesis, manufacture and/or degradation, and should summarise the basis for setting the acceptance criteria for individual and total impurities. The QOS should also summarise the impurity levels in batches of the drug substance used in the non-clinical studies, in the clinical trials, and in typical batches manufactured by the proposed commercial process. The QOS should state how the proposed impurity limits are qualified.
– A tabulated summary of the data provided in 3.2.S.3.2, with graphical representation, where appropriate should be included.
2.3.S.4 原薬の管理
- 規格及び試験方法の妥当性、試験方法及びその分析法バリデーションに関する簡潔な要約を示す。
- 3.2.S.4.1 記載の規格及び試験方法を示す。
- 3.2.S.4.4 記載のロット分析の表形式のまとめ。適宜、図示。-3.2.S.3.2 記載のデータの表形式のまとめ。適宜、図示。
2.3.S.4 Control of Drug Substance
- A brief summary of the justification of the specification(s), the analytical procedures, and validation should be included.
- Specification from 3.2.S.4.1 should be provided.
- A tabulated summary of the batch analyses from 3.2.S.4.4, with graphical representation where appropriate, should be provided.
2.3.S.5 標準品又は標準物質
- 3.2.S.5 の記載内容について、適宜、表にして示す。
2.3.S.5 Reference Standards or Materials
- Information from 3.2.S.5 (tabulated presentation, where appropriate) should be included.
2.3.S.6 容器及び施栓系
- 3.2.S.6 の記載内容について、簡潔な記述と考察を行う。
2.3.S.6 Container Closure System
- A brief description and discussion of the information, from 3.2.S.6 should be included.
2.3.S.7 安定性
- 3.2.S.7.1 記載の実施した試験の要約(条件、ロット、試験方法)、その結果の簡潔な考察及び結論、適宜、貯蔵方法、リテスト期間又は有効期間について示す。
- 3.2.S.7.2 記載の承認後の安定性試験計画を示す。
- 3.2.S.7.3 記載の安定性試験結果の表形式のまとめ。適宜、図示。
2.3.S.7 Stability
- This section should include a summary of the studies undertaken (conditions, batches, analytical procedures) and a brief discussion of the results and conclusions, the proposed storage conditions, retest date or shelf-life, where relevant, as described in 3.2.S.7.1.
- The post-approval stability protocol, as described in 3.2.S.7.2, should be included.
- A tabulated summary of the stability results from 3.2.S.7.3, with graphical representation where appropriate, should be provided.










